ชุดแยก RNA ทั้งหมดของพืชพร้อมชุด Total RNA Purificaiton สำหรับพืชที่อุดมด้วยโพลีแซคคาไรด์และโพลีฟีนอล
ข้อมูลจำเพาะ
เตรียม 50, เตรียม 200
ชุดอุปกรณ์นี้ใช้ spin column และสูตรที่พัฒนาโดย Foregene ซึ่งสามารถสกัด RNA ทั้งหมดที่มีความบริสุทธิ์สูงและมีคุณภาพสูงได้อย่างมีประสิทธิภาพจากเนื้อเยื่อพืชต่างๆ ที่มีปริมาณโพลีแซคคาไรด์หรือโพลีฟีนอลสูงมีคอลัมน์ทำความสะอาด DNA ที่สามารถกำจัด DNA จีโนมออกจาก supernatant และเนื้อเยื่อ lysate ได้อย่างง่ายดายคอลัมน์ RNA เท่านั้นสามารถผูก RNA ได้อย่างมีประสิทธิภาพชุดอุปกรณ์สามารถประมวลผลตัวอย่างจำนวนมากได้ในเวลาเดียวกัน
ทั้งระบบไม่มี RNase ดังนั้น RNA ที่บริสุทธิ์จะไม่ถูกย่อยสลายBuffer PRW1 และ Buffer PRW2 สามารถรับประกันได้ว่า RNA ที่ได้รับจะไม่ปนเปื้อนด้วยโปรตีน, DNA, ไอออน และสารประกอบอินทรีย์
ส่วนประกอบของชุด
| บัฟเฟอร์ PSL1, บัฟเฟอร์ PS, บัฟเฟอร์ PSL2 |
| บัฟเฟอร์ PRW1 บัฟเฟอร์ PRW2 |
| RNase ฟรี ddH2O คอลัมน์ทำความสะอาด DNA |
| คอลัมน์ RNA เท่านั้น |
คุณสมบัติและข้อดี
■ การทำงานที่อุณหภูมิห้อง (15-25℃) ตลอดกระบวนการทั้งหมด โดยไม่มีอ่างน้ำแข็งและการหมุนเหวี่ยงที่อุณหภูมิต่ำ
■ ชุดสมบูรณ์ RNase-Free ไม่ต้องกังวลเกี่ยวกับการย่อยสลาย RNA
■ เหมาะอย่างยิ่งสำหรับการทำให้บริสุทธิ์ RNA จากตัวอย่างพืชของโพลีแซคคาไรด์และโพลีฟีนอล
■ DNA-Cleaning Column จับกับ DNA โดยเฉพาะ เพื่อให้ชุดอุปกรณ์สามารถกำจัดการปนเปื้อนของ DNA ในจีโนมโดยไม่ต้องเพิ่ม DNase
■ ผลผลิต RNA สูง: คอลัมน์ RNA เท่านั้นและสูตรเฉพาะสามารถทำให้ RNA บริสุทธิ์ได้อย่างมีประสิทธิภาพ
■ ความเร็วที่รวดเร็ว: ใช้งานง่ายและสามารถทำได้ภายใน 30 นาที
■ ความปลอดภัย: ไม่จำเป็นต้องใช้สารอินทรีย์
■ คุณภาพสูง: ชิ้นส่วน RNA ที่บริสุทธิ์มีความบริสุทธิ์สูง ปราศจากโปรตีนและสิ่งเจือปนอื่นๆ และสามารถตอบสนองการใช้งานเชิงทดลองขั้นปลายได้หลากหลาย
พารามิเตอร์ผลิตภัณฑ์
■ การใช้งานขั้นปลาย: การสังเคราะห์ cDNA สายแรก, RT-PCR, การโคลนโมเลกุล, Northern Blot เป็นต้น
■ ตัวอย่าง: เนื้อเยื่อพืชสดหรือแช่แข็งของโพลีแซคคาไรด์และโพลีฟีนอล
■ ปริมาณ: เนื้อเยื่อพืช 50 มก
■ ความสามารถในการจับ RNA สูงสุดของคอลัมน์การทำให้บริสุทธิ์: 80 μg
■ ปริมาณการชะ: 50-200 ไมโครลิตร
แอปพลิเคชันชุด
เหมาะสำหรับการสกัดและทำให้บริสุทธิ์ RNA ทั้งหมดจากตัวอย่างเนื้อเยื่อพืชสดหรือแช่แข็ง (โดยเฉพาะเนื้อเยื่อใบพืชสด) ที่มีปริมาณโพลีแซคคาไรด์และโพลีฟีนอลสูง
เวิร์กโฟลว์
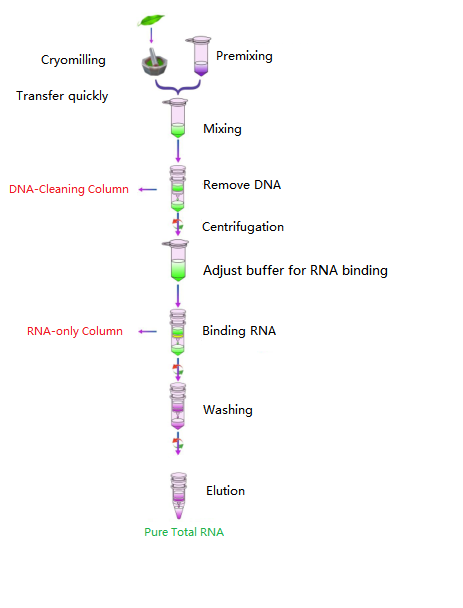
แผนภาพ
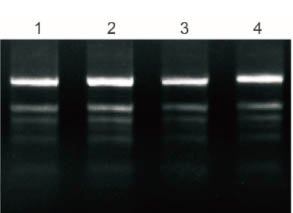
Plant Total RNA Isolation Kit Plus ประมวลผลใบสดของโพลีแซคคาไรด์และโพลีฟีนอล 50 มก. และ RNA บริสุทธิ์ 5% ได้รับการทดสอบโดยอิเล็กโทรโฟรีซิส
1: กล้วย
2: แปะก๊วย
3: ผ้าฝ้าย
4: ทับทิม
การจัดเก็บและอายุการเก็บรักษา
ชุดอุปกรณ์นี้สามารถเก็บไว้ได้นาน 24 เดือนภายใต้สภาวะแห้งที่อุณหภูมิห้อง (15-25 ℃)หากต้องการเก็บไว้เป็นเวลานาน สามารถเก็บไว้ในอุณหภูมิ 2–8 ℃
สามารถวางบัฟเฟอร์ PSL1 ไว้ที่ 4°C เป็นเวลา 1 เดือนหลังจากเติม β-เมอร์แคปโตเอทานอล (แนะนำให้เติมพร้อมกันกับการทดลอง)
เสียบคอลัมน์แล้ว
หลังจากเสียบคอลัมน์แล้ว ผลผลิต RNA จะลดลงหรือไม่สามารถทำให้ RNA บริสุทธิ์ได้ และมวล RNA ที่ได้รับก็ต่ำ
การวิเคราะห์สาเหตุทั่วไป:
1. การแบ่งตัวอย่างไม่ทั่วถึง
การแตกตัวของตัวอย่างไม่ได้ทำให้ DNA-CLEANING COLUMN ถูกบล็อกอย่างสมบูรณ์ ในขณะที่ส่งผลต่อผลผลิตและคุณภาพของ RNAเราแนะนำให้ทำการบดอย่างรวดเร็วในไนโตรเจนเหลวที่เพียงพอเมื่อคุณหักตัวอย่าง พยายามบดตัวอย่างผนังเซลล์ เยื่อหุ้มเซลล์ และเนื้อเยื่ออื่นๆสำหรับตัวอย่างพืชของโพลิออลโพลีแซคคาไรด์ เราขอแนะนำให้คุณใช้ Plant Total RNA ISOLATION KIT PLUS
2. เมื่อดูดตัวอย่างเหนือตะกอนที่แยกออกมาด้วยคอลัมน์ทำความสะอาดดีเอ็นเอ อาจสูดดมการตกตะกอนที่แตกเป็นเสี่ยงของเซลล์
ตะกอนที่แยกส่วนของเซลล์ที่ถูกถ่ายจะทำให้เกิดคอลัมน์ RNA-ONLY ซึ่งจะถูกบล็อกเมื่อดำเนินการดูดซับ RNA (ดูขั้นตอนที่ 6)เราขอแนะนำให้คุณระมัดระวังในการดูดสารลอยเหนือตะกอนนี้เพื่อหลีกเลี่ยงการดูดเศษเซลล์
3. จำนวนเงินเริ่มต้นของตัวอย่างมากเกินไป
การใช้ตัวอย่างมากเกินไปจะส่งผลให้เกิดการแยกส่วนตัวอย่างที่ไม่สมบูรณ์หรือการสลายเซลล์ที่ไม่สมบูรณ์โดย Buffer PSL1 ส่งผลให้เกิดการอุดตันของคอลัมน์การทำให้บริสุทธิ์ระหว่างการทำให้บริสุทธิ์ชุดแยก RNA ทั้งหมดของพืช ตัวอย่างปฏิบัติการบริสุทธิ์แต่ละตัวอย่างคือ 50 มก.สำหรับตัวอย่างพืชของโพลิออลโพลีแซคคาไรด์ เราขอแนะนำให้คุณลองใช้ Plant Total RNA ISOLATION KIT PLUS
4. อุณหภูมิของเครื่องหมุนเหวี่ยงต่ำเกินไป
กระบวนการแยก RNA และการทำให้บริสุทธิ์ทั้งหมดดำเนินการที่อุณหภูมิห้อง (20-25°C) ยกเว้นว่าเนื้อเยื่อตัวอย่างถูกทำลายด้วยไนโตรเจนเหลว อุณหภูมิของเครื่องปั่นแยกความเย็นบางชนิดต่ำกว่า 20℃ซึ่งอาจทำให้เกิดการอุดตันของ DNA-Cleaning Column และ/หรือ RNA-Only Columnในกรณีนี้ ให้ตั้งอุณหภูมิเครื่องหมุนเหวี่ยงไปที่ 20-25℃, และตรวจสอบให้แน่ใจว่าส่วนผสมของการสลายตัวและ/หรือส่วนลอยเหนือตะกอนที่เติมเอทานอลถูกอุ่นไว้ที่ 37°C.
ไม่มีการสกัด RNA หรือผลผลิต RNA ต่ำ
โดยปกติแล้วมีหลายปัจจัยที่ส่งผลต่อประสิทธิภาพการกู้คืน เช่น เนื้อหา RNA ตัวอย่าง วิธีการดำเนินการ ปริมาณการชะ ฯลฯ
การวิเคราะห์สาเหตุทั่วไปดังต่อไปนี้:
1.ทำการหมุนเหวี่ยงในอ่างน้ำแข็งหรือที่อุณหภูมิต่ำ (4°C) ระหว่างการทำงาน
คำแนะนำ: ใช้งานที่อุณหภูมิห้อง (15-25°C) ในกระบวนการทั้งหมด ห้ามทำอ่างน้ำแข็งและการหมุนเหวี่ยงที่อุณหภูมิต่ำ
2. RNA ถูกย่อยสลายเนื่องจากการเก็บรักษาตัวอย่างที่ไม่เหมาะสมหรือการเก็บรักษาตัวอย่างในระยะยาว
คำแนะนำ: ตัวอย่างที่เก็บมาใหม่ควรแช่แข็งอย่างรวดเร็วในไนโตรเจนเหลว จากนั้นเก็บไว้ที่อุณหภูมิ -80°C เป็นเวลานาน หลีกเลี่ยงการแช่แข็งซ้ำและการละลายตัวอย่างหรือแช่ตัวอย่างทันทีในสารละลาย RNA stabilizer RNAlater (ตัวอย่างสัตว์)
3.การแยกส่วนและการสลายตัวอย่างไม่เพียงพอนำไปสู่การอุดตันของคอลัมน์การทำให้บริสุทธิ์
คำแนะนำ: เมื่อบดทิชชู่ โปรดตรวจสอบให้แน่ใจว่าทิชชู่มีเนื้อดินเพียงพอ และรีบโอนไปยัง Buffer PSL1 ที่เตรียมไว้ล่วงหน้าอย่างรวดเร็ว (ยืนยันว่าได้เพิ่มสัดส่วน β-ME ที่ถูกต้อง โปรดดูขั้นตอนที่ 1 ของขั้นตอน)
4.เติมสารชะล้างไม่ถูกต้อง
คำแนะนำ: ตรวจสอบให้แน่ใจว่าได้หยด ddH2O ที่ปราศจาก RNase ลงตรงกลางเมมเบรนของคอลัมน์การทำให้บริสุทธิ์
5.ไม่ได้เติมเอทานอลสัมบูรณ์ในปริมาตรที่ถูกต้องลงใน Buffer PSL2 หรือ Buffer PRW2
คำแนะนำ: โปรดปฏิบัติตามคำแนะนำ เติมเอทานอลสัมบูรณ์ในปริมาตรที่ถูกต้องลงใน Buffer PSL2 และ Buffer PRW2 และผสมให้เข้ากันก่อนใช้ชุด
6.ปริมาณตัวอย่างเนื้อเยื่อไม่เหมาะสม
คำแนะนำ: ใช้ทิชชู่ 50 มก. ต่อ Buffer PSL1 500 ไมโครลิตรการใช้เนื้อเยื่อมากเกินไปจะลดปริมาณ RNA ที่สกัดได้ และความบริสุทธิ์ของ RNA ที่ได้ก็จะลดลงด้วยเราแนะนำอย่างยิ่งว่าปริมาณตัวอย่างเริ่มต้นไม่ควรเกิน 50 มก. ต่อการดำเนินการสกัด RNA
7.ปริมาณการชะที่ไม่เหมาะสมหรือการชะที่ไม่สมบูรณ์
คำแนะนำ: ปริมาตรชะล้างของคอลัมน์ทำให้บริสุทธิ์คือ 50-200 ไมโครลิตร;หากผลการชะไม่เป็นที่พอใจ แนะนำให้ยืดเวลาที่อุณหภูมิห้องหลังจากเติม ddH2O ที่ปราศจาก RNase ที่อุ่นแล้ว เช่น 5-10 นาที
8.คอลัมน์การทำให้บริสุทธิ์มีเอทานอลตกค้างหลังจากล้างด้วย BufferPRW2
คำแนะนำ: หากหลอดเปล่าถูกปั่นแยกเป็นเวลา 1 นาที และยังมีเอทานอลเหลืออยู่หลังจากล้างใน Buffer PRW2 คุณสามารถเพิ่มเวลาปั่นแยกหลอดเปล่าเป็น 2 นาที หรือวางคอลัมน์ทำให้บริสุทธิ์ที่อุณหภูมิห้องเป็นเวลา 5 นาทีเพื่อขจัดเอทานอลที่ตกค้างออกให้หมด
9. ใช้ชุดอุปกรณ์อย่างไม่ถูกต้อง
คำแนะนำ: สำหรับตัวอย่างพืชของโพลีฟีนอลิกโพลีแซคคาไรด์ การใช้ชุดอุปกรณ์ทั่วไป เช่น ชุดแยก RNA ของโรงงานทั้งหมด อาจไม่สามารถรับตัวอย่าง RNA ที่เหมาะสมได้เราขอแนะนำให้คุณใช้ Plant Total RNA IsolationKit Plus ซึ่งออกแบบมาเป็นพิเศษสำหรับตัวอย่างพืชที่มีโพลีฟีนอลโพลีแซคคาไรด์ชุดอุปกรณ์ที่พัฒนาขึ้นเป็นพิเศษสำหรับการสกัด RNA จากตัวอย่างพืชโพลีฟีนอลและโพลีแซคคาไรด์
ค่า OD260/OD280 ต่ำ
การชะ RNA ด้วย ddH2O และใช้สำหรับการอ่านค่าสเปกโตรโฟโตมิเตอร์ทำให้ค่า OD260/OD280 ต่ำเราแนะนำให้ใช้ 10 mM Tris-HCl, pH 7.5 (แทนที่จะใช้ ddH2O ที่ปราศจาก RNase เพื่อชะล้าง RNA) เพื่อให้ได้ค่า OD260/OD280 ที่ค่อนข้างถูกต้อง โปรดดู “การวิเคราะห์ความเข้มข้นของ RNA และการทำให้บริสุทธิ์” บนหน้าที่ 19
RNA ที่บริสุทธิ์จะถูกย่อยสลาย
คุณภาพของ RNA ที่บริสุทธิ์เกี่ยวข้องกับปัจจัยต่างๆ เช่น การเก็บรักษาตัวอย่าง การปนเปื้อนของ RNase และการจัดการ
การวิเคราะห์สาเหตุทั่วไป:
1.เก็บตัวอย่างเนื้อเยื่อไม่ทันเวลาหลังเก็บ
คำแนะนำ: หากตัวอย่างเนื้อเยื่อไม่ได้ใช้หลังจากเก็บเสร็จทันเวลา โปรดเก็บไว้ในไนโตรเจนเหลวที่อุณหภูมิต่ำทันที หรือย้ายไปที่อุณหภูมิ -80°C เพื่อเก็บไว้ระยะยาวหลังจากแช่แข็งอย่างรวดเร็วในไนโตรเจนเหลว หรือแช่ตัวอย่างทันทีในสารละลาย RNA stabilizer RNAlater (ตัวอย่างสัตว์)สำหรับการสกัด RNA ให้ลองใช้ตัวอย่างเนื้อเยื่อที่เก็บมาใหม่
2. การแช่แข็งซ้ำและการละลายตัวอย่างเนื้อเยื่อ
คำแนะนำ: เมื่อเก็บตัวอย่างเนื้อเยื่อ ทางที่ดีควรตัดเป็นชิ้นเล็กๆ เพื่อการเก็บรักษา และนำส่วนหนึ่งออกเมื่อใช้เพื่อหลีกเลี่ยงการสลายตัวของ RNA ที่เกิดจากการแช่แข็งซ้ำๆ และการละลายของตัวอย่าง
3.RNase ถูกนำมาใช้ในห้องผ่าตัดหรือไม่สวมถุงมือ หน้ากาก ฯลฯ
คำแนะนำ: การทดลองสกัด RNA ทำได้ดีที่สุดในการดำเนินการแยก RNA และควรทำความสะอาดโต๊ะในห้องปฏิบัติการก่อนการทดลอง และควรสวมถุงมือและหน้ากากแบบใช้แล้วทิ้งในระหว่างการทดลองเพื่อหลีกเลี่ยงการย่อยสลาย RNA ที่เกิดจากการแนะนำของ RNase ในระดับสูงสุด
4. รีเอเจนต์ถูกปนเปื้อนโดย RNase ระหว่างการใช้งาน
คำแนะนำ: แทนที่ด้วยชุดการสกัด RNA ทั้งหมดของพืชชุดใหม่สำหรับการทดลองที่เกี่ยวข้อง
5.หลอด centrifuge และปลายปิเปตที่ใช้สำหรับการจัดการ RNA นั้นปนเปื้อนด้วย RNase
คำแนะนำ: ตรวจสอบให้แน่ใจว่าหลอดปั่นแยก ทิปปิเปต ปิเปต ฯลฯ ที่ใช้ในการสกัด RNA ทั้งหมดปราศจาก RNase
คู่มือการใช้งาน:
คู่มือการใช้งาน Plant Total RNA Isolation Kit Plus