ชุดแยก RNA ทั้งหมดของพืช ชุดรวม RNA Purificaiton สำหรับพืชที่มีโพลีแซคคาไรด์และโพลีฟีนอลต่ำ
ข้อมูลจำเพาะ
เตรียม 50, เตรียม 200
ชุดอุปกรณ์นี้ใช้ spin column และสูตรที่พัฒนาโดย Foregene ซึ่งสามารถสกัด RNA ทั้งหมดที่มีความบริสุทธิ์สูงและมีคุณภาพสูงได้อย่างมีประสิทธิภาพจากเนื้อเยื่อพืชต่างๆ ที่มีปริมาณโพลีแซคคาไรด์และโพลีฟีนอลต่ำสำหรับตัวอย่างพืชที่มีปริมาณโพลีแซคคาไรด์หรือโพลีฟีนอลสูง ขอแนะนำให้ใช้ Plant Total RNA Isolation Plus Kit เพื่อให้ได้ผลการสกัด RNA ที่ดีขึ้นชุดนี้มีคอลัมน์ทำความสะอาด DNA ที่สามารถกำจัด DNA จีโนมออกจาก supernatant และเนื้อเยื่อ lysate ได้อย่างง่ายดายคอลัมน์ RNA เท่านั้นสามารถผูก RNA ได้อย่างมีประสิทธิภาพชุดอุปกรณ์สามารถประมวลผลตัวอย่างจำนวนมากได้ในเวลาเดียวกัน
ทั้งระบบไม่มี RNase ดังนั้น RNA ที่บริสุทธิ์จะไม่ถูกย่อยสลายBuffer PRW1 และ Buffer PRW2 สามารถรับประกันได้ว่า RNA ที่ได้รับจะไม่ปนเปื้อนด้วยโปรตีน, DNA, ไอออน และสารประกอบอินทรีย์
ส่วนประกอบของชุด
| บัฟเฟอร์ PSL1, บัฟเฟอร์ PS, บัฟเฟอร์ PSL2 |
| บัฟเฟอร์ PRW1 บัฟเฟอร์ PRW2 |
| RNase ฟรี ddH2O คอลัมน์ทำความสะอาด DNA |
| คอลัมน์ RNA เท่านั้น |
| คำแนะนำ |
คุณสมบัติและข้อดี
■ การทำงานที่อุณหภูมิห้อง (15-25℃) ตลอดกระบวนการทั้งหมด โดยไม่มีอ่างน้ำแข็งและการหมุนเหวี่ยงที่อุณหภูมิต่ำ
■ ชุดสมบูรณ์ RNase-Free ไม่ต้องกังวลเกี่ยวกับการย่อยสลาย RNA
■ DNA-Cleaning Column จับกับ DNA โดยเฉพาะ เพื่อให้ชุดอุปกรณ์สามารถกำจัดการปนเปื้อนของ DNA ในจีโนมโดยไม่ต้องเพิ่ม DNase
■ ผลผลิต RNA สูง: คอลัมน์ RNA เท่านั้นและสูตรเฉพาะสามารถทำให้ RNA บริสุทธิ์ได้อย่างมีประสิทธิภาพ
■ ความเร็วที่รวดเร็ว: ใช้งานง่ายและสามารถทำได้ภายใน 30 นาที
■ ความปลอดภัย: ไม่จำเป็นต้องใช้สารอินทรีย์
■ คุณภาพสูง: ชิ้นส่วน RNA ที่บริสุทธิ์มีความบริสุทธิ์สูง ปราศจากโปรตีนและสิ่งเจือปนอื่นๆ และสามารถตอบสนองการใช้งานเชิงทดลองขั้นปลายได้หลากหลาย
แอปพลิเคชันชุด
เหมาะสำหรับการสกัดและทำให้บริสุทธิ์ RNA ทั้งหมดจากตัวอย่างเนื้อเยื่อพืชสดหรือแช่แข็ง (โดยเฉพาะเนื้อเยื่อใบพืชสด) ที่มีปริมาณโพลีแซคคาไรด์และโพลีฟีนอลต่ำ
เวิร์กโฟลว์
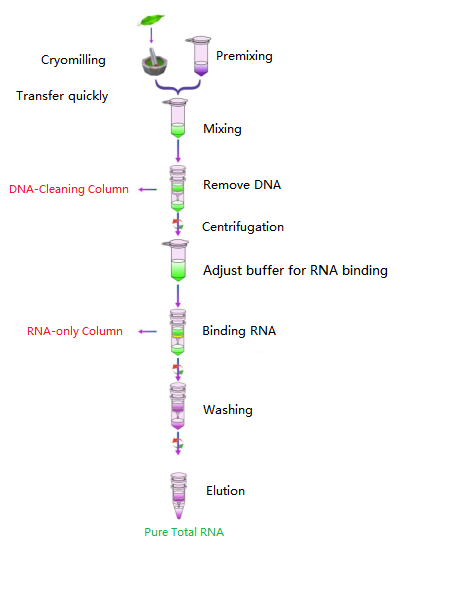
แผนภาพ
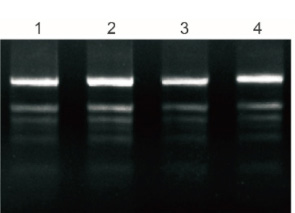
Plant Total RNA Isolation Kit Plus ประมวลผลใบสดของโพลีแซคคาไรด์และโพลีฟีนอล 50 มก. และ RNA บริสุทธิ์ 5% ได้รับการทดสอบโดยอิเล็กโทรโฟรีซิส
1: กล้วย
2: แปะก๊วย
3: ผ้าฝ้าย
4: ทับทิม
การจัดเก็บและอายุการเก็บรักษา
ชุดอุปกรณ์สามารถเก็บไว้ได้นาน 12 เดือนที่อุณหภูมิห้อง (15–25 ℃) ในสภาพแวดล้อมที่แห้ง และเก็บได้นาน 2–8 ℃ (24 เดือน)
บัฟเฟอร์ PSL1 สามารถเก็บไว้ที่ 4 ℃ เป็นเวลา 1 เดือนหลังจากเติม 2-ไฮดรอกซี-1-เอเธนไทออล
คู่มือวิเคราะห์ปัญหา
การวิเคราะห์ปัญหาที่คุณอาจพบต่อไปนี้ผลรวมของพืชRNA extraction will help you with your experiments. In addition, for other experimental or technical problems in addition to operating instructions and problem analysis, we have dedicated technical support to help you. If you have any needs, please contact us at: 028-83360257 or E-mali : Tech@foregene.com.
แกนหมุนอุดตัน
การอุดตันของ spin column จะทำให้ผลผลิต RNA ลดลง หรือแม้แต่ไม่สามารถทำให้บริสุทธิ์เพื่อให้ได้ RNA ได้ และคุณภาพของ RNA ที่ได้รับก็จะต่ำ
การวิเคราะห์สาเหตุทั่วไป:
1. ตัวอย่างไม่สมบูรณ์
การกระจายตัวของตัวอย่างที่ไม่สมบูรณ์สามารถปิดกั้นคอลัมน์ทำความสะอาด DNA ซึ่งอาจส่งผลต่อผลผลิตและคุณภาพของ RNAเราขอแนะนำว่าเมื่อทำการแยกชิ้นส่วนตัวอย่าง ให้บดไนโตรเจนเหลวในปริมาณที่เพียงพออย่างรวดเร็วเพื่อสลายเนื้อเยื่อ เช่น ผนังเซลล์และเยื่อหุ้มเซลล์ของตัวอย่างให้ได้มากที่สุดสำหรับตัวอย่างพืชที่มีโพลีฟีนอลโพลีแซคคาไรด์ เราขอแนะนำให้คุณใช้ Plant Total RNA Isolation Kit Plus
2. ดูดสารเหนือตะกอนที่แยกจากคอลัมน์ทำความสะอาด DNA ดูดเม็ดเศษเซลล์ที่เป็นไปได้
เม็ดเศษเซลล์ที่ถูกสำลักสามารถอุดตันคอลัมน์ RNA เท่านั้นในระหว่างขั้นตอนการดูดซับ RNA (ดูขั้นตอนที่ 5 ของขั้นตอน ขั้นตอนที่ 6 ของขั้นตอนโพลีแซคคาไรด์โพลีฟีนอล)เราแนะนำว่าต้องใช้ความระมัดระวังเมื่อดูดสารลอยเหนือตะกอนนี้เพื่อหลีกเลี่ยงการดูดเศษเซลล์
3. จำนวนตัวอย่างเริ่มต้นมากเกินไป
การใช้ตัวอย่างมากเกินไปจะส่งผลให้การแยกส่วนตัวอย่างไม่สมบูรณ์หรือการสลายเซลล์ที่ไม่สมบูรณ์โดย Buffer PRL1 หรือ Buffer PSL1 ส่งผลให้คอลัมน์การทำให้บริสุทธิ์อุดตันสำหรับการดำเนินการทำให้บริสุทธิ์ชุดแยก RNA ทั้งหมดของพืชมีค่าสูงสุดเริ่มต้นที่ 50 มก. ต่อการทำให้บริสุทธิ์เพียงครั้งเดียวของตัวอย่างที่ดำเนินการสำหรับตัวอย่างพืชของโพลีฟีนอลโพลีแซคคาไรด์ เราขอแนะนำให้คุณลองใช้ Plant Total RNA Isolation Kit Plus
4. อุณหภูมิของเครื่องหมุนเหวี่ยงต่ำเกินไป
การแยก RNA ทั้งหมดและการทำให้บริสุทธิ์ ยกเว้นการหยุดชะงักของไนโตรเจนเหลวของเนื้อเยื่อตัวอย่าง ทุกขั้นตอนดำเนินการที่อุณหภูมิห้อง (20-25 °C)เครื่องหมุนเหวี่ยงอุณหภูมิต่ำบางรุ่นมีอุณหภูมิต่ำกว่า 20 °C ซึ่งอาจทำให้เกิดการอุดตันในคอลัมน์ทำความสะอาด DNA และ/หรือคอลัมน์เฉพาะ RNAหากสิ่งนี้เกิดขึ้น ให้ตั้งอุณหภูมิเครื่องปั่นเหวี่ยงไปที่ 20-25 °C และอุ่นส่วนผสมสำหรับการสลายตัวและ/หรือการเติมส่วนลอยของการแยกเอทานอลล่วงหน้าเป็น 37 °C
ไม่มีการสกัด RNA หรือผลผลิต RNA ต่ำ
โดยปกติแล้วมีหลายปัจจัยที่ส่งผลต่อประสิทธิภาพการกู้คืน เช่น เนื้อหา RNA ตัวอย่าง วิธีการดำเนินการ ปริมาณการชะ ฯลฯ
การวิเคราะห์สาเหตุทั่วไปดังต่อไปนี้:
1.ทำการหมุนเหวี่ยงในอ่างน้ำแข็งหรือที่อุณหภูมิต่ำ (4°C) ระหว่างการทำงาน
คำแนะนำ: ใช้งานที่อุณหภูมิห้อง (15-25°C) ตลอดกระบวนการ ห้ามแช่ในอ่างน้ำแข็งและการหมุนเหวี่ยงที่อุณหภูมิต่ำ
2.RNA ถูกย่อยสลายเนื่องจากการเก็บรักษาตัวอย่างที่ไม่เหมาะสมหรือการเก็บรักษาตัวอย่างในระยะยาว
คำแนะนำ: ตัวอย่างที่เก็บมาใหม่ควรแช่แข็งอย่างรวดเร็วในไนโตรเจนเหลว จากนั้นเก็บไว้ที่อุณหภูมิ -80°C เป็นเวลานาน หลีกเลี่ยงการแช่แข็งซ้ำและการละลายตัวอย่างหรือแช่ตัวอย่างทันทีในสารละลาย RNA stabilizer RNAlater (ตัวอย่างสัตว์)
3.การกระจายตัวและการสลายตัวอย่างไม่เพียงพอนำไปสู่การอุดตันของคอลัมน์การทำให้บริสุทธิ์
คำแนะนำ: เมื่อบดทิชชู่ โปรดตรวจสอบให้แน่ใจว่าทิชชู่มีเนื้อดินเพียงพอ และรีบโอนไปยัง Buffer PSL1 ที่เตรียมไว้ล่วงหน้าอย่างรวดเร็ว (ยืนยันว่าได้เพิ่มสัดส่วน β-ME ที่ถูกต้อง โปรดดูขั้นตอนที่ 1 ของขั้นตอน)
4.เติมสารชะล้างไม่ถูกต้อง
คำแนะนำ: ตรวจสอบให้แน่ใจว่า RNase-Free ddH2O หยดลงตรงกลางเมมเบรนของคอลัมน์การทำให้บริสุทธิ์
5.ไม่ได้เติมเอทานอลสัมบูรณ์ในปริมาตรที่ถูกต้องลงใน Buffer PSL2 หรือ Buffer PRW2
คำแนะนำ: โปรดปฏิบัติตามคำแนะนำ เติมเอทานอลสัมบูรณ์ในปริมาตรที่ถูกต้องลงใน Buffer PSL2 และ Buffer PRW2 และผสมให้เข้ากันก่อนใช้ชุด
6.ปริมาณตัวอย่างเนื้อเยื่อไม่เหมาะสม
คำแนะนำ: ใช้ทิชชู่ 50 มก. ต่อ Buffer PSL1 500 ไมโครลิตรการใช้เนื้อเยื่อมากเกินไปจะลดปริมาณ RNA ที่สกัดได้ และความบริสุทธิ์ของ RNA ที่ได้ก็จะลดลงด้วยเราแนะนำอย่างยิ่งว่าปริมาณตัวอย่างเริ่มต้นไม่ควรเกิน 50 มก. ต่อการดำเนินการสกัด RNA
7. ปริมาณการชะที่ไม่เหมาะสมหรือการชะที่ไม่สมบูรณ์
คำแนะนำ: ปริมาตรชะล้างของคอลัมน์ทำให้บริสุทธิ์คือ 50-200 ไมโครลิตร;หากผลการชะไม่เป็นที่พอใจ แนะนำให้ยืดเวลาที่อุณหภูมิห้องหลังจากเติม ddH ที่ปราศจาก RNase ที่อุ่นแล้ว2O เช่น 5-10min.
8.คอลัมน์การทำให้บริสุทธิ์มีเอธานอลตกค้างหลังจากล้างด้วย Buffer PRW2
คำแนะนำ: หากหลอดเปล่าถูกปั่นแยกเป็นเวลา 1 นาที และยังมีเอทานอลเหลืออยู่หลังจากล้างใน Buffer PRW2 คุณสามารถเพิ่มเวลาปั่นแยกหลอดเปล่าเป็น 2 นาที หรือวางคอลัมน์ทำให้บริสุทธิ์ที่อุณหภูมิห้องเป็นเวลา 5 นาทีเพื่อขจัดเอทานอลที่ตกค้างออกให้หมด
9. ใช้ชุดอุปกรณ์อย่างไม่ถูกต้อง
คำแนะนำ: สำหรับตัวอย่างพืชของโพลีฟีนอลิกโพลีแซคคาไรด์ การใช้ชุดอุปกรณ์ทั่วไป เช่น ชุดแยก RNA ของโรงงานทั้งหมด อาจไม่สามารถรับตัวอย่าง RNA ที่เหมาะสมได้เราขอแนะนำให้คุณใช้ Plant Total RNA IsolationKit Plus ซึ่งออกแบบมาเป็นพิเศษสำหรับตัวอย่างพืชที่มีโพลีฟีนอลโพลีแซคคาไรด์ชุดอุปกรณ์ที่พัฒนาขึ้นเป็นพิเศษสำหรับการสกัด RNA จากตัวอย่างพืชโพลีฟีนอลและโพลีแซคคาไรด์
ค่า OD260/OD280 ต่ำ
การชะ RNA ด้วย ddH2O และใช้สำหรับการอ่านสเปกโตรโฟโตมิเตอร์ทำให้ค่า OD260/OD280 ต่ำขอแนะนำให้ใช้ Tris-HCl 10 mM, pH 7.5 (แทนที่จะเป็น RNase-Free ddH2O เพื่อชะล้าง RNA) เพื่อให้ได้ค่า OD260/OD280 ที่ค่อนข้างถูกต้อง โปรดดู “RNA Concentration and Purification Assays” บนหน้าที่ 19
RNA ที่บริสุทธิ์จะถูกย่อยสลาย
คุณภาพของ RNA ที่บริสุทธิ์เกี่ยวข้องกับปัจจัยต่างๆ เช่น การเก็บรักษาตัวอย่าง การปนเปื้อนของ RNase และการจัดการ
การวิเคราะห์สาเหตุทั่วไป:
1.เก็บตัวอย่างเนื้อเยื่อไม่ทันเวลาหลังเก็บ
คำแนะนำ: หากตัวอย่างเนื้อเยื่อไม่ได้ใช้หลังจากเก็บเสร็จทันเวลา โปรดเก็บไว้ในไนโตรเจนเหลวที่อุณหภูมิต่ำทันที หรือย้ายไปที่อุณหภูมิ -80°C เพื่อเก็บไว้ระยะยาวหลังจากแช่แข็งอย่างรวดเร็วในไนโตรเจนเหลว หรือแช่ตัวอย่างทันทีในสารละลาย RNA stabilizer RNAlater (ตัวอย่างสัตว์)สำหรับการสกัด RNA ให้ลองใช้ตัวอย่างเนื้อเยื่อที่เก็บมาใหม่
2. การแช่แข็งซ้ำและการละลายตัวอย่างเนื้อเยื่อ
คำแนะนำ: เมื่อเก็บตัวอย่างเนื้อเยื่อ ทางที่ดีควรตัดเป็นชิ้นเล็กๆ เพื่อการเก็บรักษา และนำส่วนหนึ่งออกเมื่อใช้เพื่อหลีกเลี่ยงการสลายตัวของ RNA ที่เกิดจากการแช่แข็งซ้ำๆ และการละลายของตัวอย่าง
3.RNase ถูกนำมาใช้ในห้องผ่าตัดหรือไม่สวมถุงมือ หน้ากาก ฯลฯ
คำแนะนำ: การทดลองสกัด RNA ทำได้ดีที่สุดในการดำเนินการแยก RNA และควรทำความสะอาดโต๊ะในห้องปฏิบัติการก่อนการทดลอง และควรสวมถุงมือและหน้ากากแบบใช้แล้วทิ้งในระหว่างการทดลองเพื่อหลีกเลี่ยงการย่อยสลาย RNA ที่เกิดจากการแนะนำของ RNase ในระดับสูงสุด
4. รีเอเจนต์ถูกปนเปื้อนโดย RNase ระหว่างการใช้งาน
คำแนะนำ: แทนที่ด้วยชุดการสกัด RNA ทั้งหมดของพืชชุดใหม่สำหรับการทดลองที่เกี่ยวข้อง
5.หลอด centrifuge และปลายปิเปตที่ใช้สำหรับการจัดการ RNA นั้นปนเปื้อนด้วย RNase
คำแนะนำ: ตรวจสอบให้แน่ใจว่าหลอดปั่นแยก ทิปปิเปต ปิเปต ฯลฯ ที่ใช้ในการสกัด RNA ทั้งหมดปราศจาก RNase
คู่มือการใช้งาน: