ในการทดลอง qPCR การออกแบบไพรเมอร์ก็เป็นจุดเชื่อมโยงที่สำคัญเช่นกันไพรเมอร์มีความเหมาะสมหรือไม่นั้นสัมพันธ์อย่างใกล้ชิดกับประสิทธิภาพการขยายสัญญาณถึงมาตรฐานหรือไม่ ผลิตภัณฑ์ขยายเสียงมีความเฉพาะเจาะจงหรือไม่ และมีผลการทดลองหรือไม่
แล้วจะทำให้ความจำเพาะของไพรเมอร์ qPCR ดีขึ้นได้อย่างไรประสิทธิภาพการขยายเสียงสูง?
วันนี้เราจะพาคุณไปออกแบบไพรเมอร์ qPCR ด้วยกัน และให้การออกแบบไพรเมอร์ qPCR กลายเป็นทักษะในตำนานที่มีประสิทธิภาพในการทดลอง
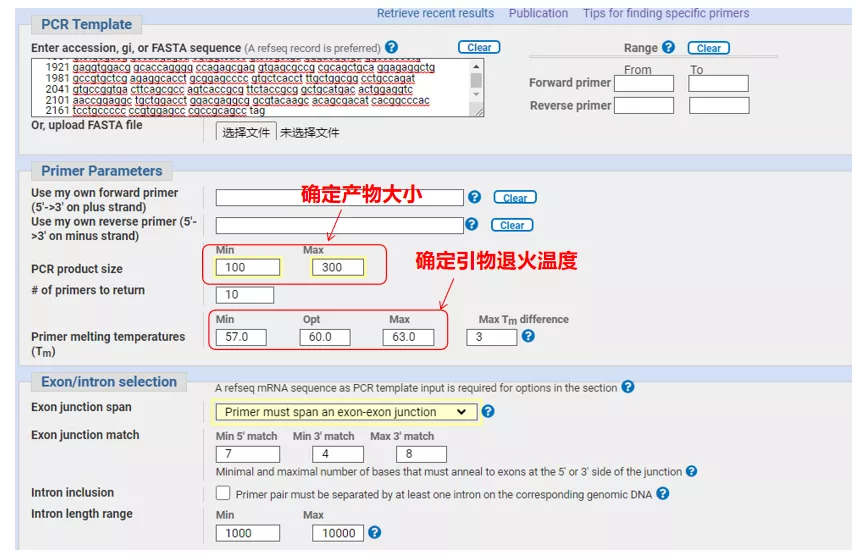
เมื่อออกแบบไพรเมอร์ qPCR มักจะให้ความสนใจกับประเด็นต่อไปนี้: ไพรเมอร์ควรออกแบบข้าม introns ให้มากที่สุดเท่าที่จะเป็นไปได้ ความยาวของผลิตภัณฑ์ควรอยู่ที่ 100-300 bp ค่า Tm ควรใกล้เคียงกับ 60°C มากที่สุด และไพรเมอร์ต้นน้ำและปลายน้ำควรอยู่ใกล้กันมากที่สุด และปลายของไพรเมอร์ควรเป็น G หรือ C เป็นต้น รอสักครู่
1. การออกแบบไพรเมอร์ที่ทอดผ่านอินตรอน
เมื่อออกแบบไพรเมอร์ qPCR การเลือกไพรเมอร์ที่ออกแบบข้ามอินตรอนสามารถป้องกันไม่ให้แม่แบบ gDNA ถูกขยาย และผลิตภัณฑ์ทั้งหมดได้มาจากการขยายของ cDNA จึงช่วยขจัดอิทธิพลของการปนเปื้อนของ gDNA
2. ความยาวของไพรเมอร์
โดยทั่วไปความยาวของไพรเมอร์อยู่ระหว่าง 18-30 nt และความยาวของผลิตภัณฑ์ขยายควรควบคุมระหว่าง 100-300 bp มากที่สุดเท่าที่จะเป็นไปได้
หากไพรเมอร์สั้นเกินไป จะนำไปสู่การขยายที่ไม่เฉพาะเจาะจง และหากยาวเกินไป จะทำให้เกิดโครงสร้างรอง (เช่น โครงสร้างกิ๊บ) ได้ง่ายหากผลิตภัณฑ์แอมพลิฟายเออร์ยาวเกินไป จะไม่เหมาะสำหรับปฏิกิริยาของพอลิเมอเรส ซึ่งจะส่งผลต่อประสิทธิภาพของการขยาย PCR
3. เนื้อหา GC และค่า Tm
ควรควบคุมเนื้อหา GC ของไพรเมอร์ระหว่าง 40% ถึง 60%หากสูงหรือต่ำเกินไป จะไม่เอื้อต่อการเริ่มต้นปฏิกิริยาเนื้อหา GC ของไพรเมอร์ไปข้างหน้าและย้อนกลับควรใกล้เคียงกันเพื่อให้ได้ค่า Tm และอุณหภูมิการหลอมที่เท่ากัน
ค่า Tm ควรอยู่ระหว่าง 55-65°C เท่าที่เป็นไปได้ โดยทั่วไปประมาณ 60°C และค่า Tm ของต้นน้ำและปลายน้ำควรใกล้เคียงกันมากที่สุด โดยไม่ควรเกิน 4°C
4. หลีกเลี่ยงการเลือก A ที่ปลาย 3 ′ของไพรเมอร์
เมื่อปลายไพรเมอร์ 3 ′ไม่ตรงกัน ประสิทธิภาพการสังเคราะห์ของเบสที่แตกต่างกันจะมีความแตกต่างกันอย่างมากเมื่อฐานสุดท้ายคือ A ยังสามารถเริ่มต้นการสังเคราะห์ลูกโซ่ได้แม้ในกรณีที่ไม่ตรงกัน และเมื่อฐานสุดท้ายคือ T เมื่อ ประสิทธิภาพของการเหนี่ยวนำที่ไม่ตรงกันจะลดลงอย่างมากดังนั้น พยายามหลีกเลี่ยงการเลือก A ที่ปลายไพรเมอร์ 3 นิ้ว และเลือก T จะดีกว่า
หากเป็นไพรเมอร์ของโพรบ ปลายโพรบ 5′ จะเป็น G ไม่ได้ เพราะแม้เมื่อฐาน G เดียวเชื่อมต่อกับกลุ่มนักข่าวฟลูออเรสเซนต์ FAM G ยังสามารถดับสัญญาณฟลูออเรสเซนต์ที่ปล่อยออกมาจากกลุ่ม FAM ส่งผลให้เกิดผลลัพธ์เชิงลบที่ผิดพลาดปรากฏ.
5. การกระจายฐาน
การกระจายของฐานทั้งสี่ในไพรเมอร์ควรเป็นแบบสุ่ม หลีกเลี่ยงมากกว่า 3 G หรือ C ติดต่อกันที่ปลาย 3 ′และมากกว่า 3 ติดต่อกันG หรือ C นั้นง่ายต่อการสร้างการจับคู่ในภูมิภาคลำดับที่มี GC
6. พื้นที่การออกแบบสีรองพื้นควรหลีกเลี่ยงโครงสร้างทุติยภูมิที่ซับซ้อน
โครงสร้างทุติยภูมิที่เกิดขึ้นจากเส้นใยเดี่ยวของผลิตภัณฑ์ขยายจะส่งผลต่อความก้าวหน้าที่ราบรื่นของ PCRด้วยการทำนายล่วงหน้าว่ามีโครงสร้างรองในลำดับเป้าหมายหรือไม่ ให้พยายามหลีกเลี่ยงบริเวณนี้ในการออกแบบไพรเมอร์
7. ไพรเมอร์เองและระหว่างไพรเมอร์ควรพยายามหลีกเลี่ยงเบสเสริมที่ต่อเนื่องกัน
ไม่มีส่วนประกอบพื้นฐาน 4 ตัวติดต่อกันระหว่างไพรเมอร์เองและไพรเมอร์ไพรเมอร์เองไม่ควรมีลำดับเสริม มิฉะนั้น จะพับตัวเองเพื่อสร้างโครงสร้างกิ๊บติดผม ซึ่งจะส่งผลต่อการหลอมรวมกันของไพรเมอร์และแม่แบบ
ไม่สามารถมีลำดับที่สมบูรณ์ระหว่างไพรเมอร์ต้นน้ำและปลายน้ำการเสริมกันระหว่างไพรเมอร์จะทำให้เกิดไพรเมอร์ไดเมอร์ ซึ่งจะลดประสิทธิภาพ PCR และแม้แต่ส่งผลต่อความแม่นยำเชิงปริมาณหากไม่สามารถหลีกเลี่ยงโครงสร้างไพรเมอร์-ไดเมอร์และกิ๊บได้ ค่า △G ไม่ควรสูงเกินไป (ควรน้อยกว่า 4.5 กิโลแคลอรี/โมล)
8. ไพรเมอร์ช่วยขยายผลิตภัณฑ์เฉพาะเป้าหมาย
เป้าหมายสูงสุดของการตรวจหา qPCR คือการทำความเข้าใจความชุกชุมของยีนเป้าหมายหากเกิดการขยายที่ไม่เฉพาะเจาะจง การหาปริมาณจะไม่ถูกต้องดังนั้น หลังจากออกแบบไพรเมอร์แล้ว จึงจำเป็นต้องทดสอบโดย BLAST และเปรียบเทียบความจำเพาะของผลิตภัณฑ์ในฐานข้อมูลลำดับ
ต่อไป เราใช้ยีน GAS6 (Growth arrest specification 6) ของมนุษย์เป็นตัวอย่างในการออกแบบไพรเมอร์ qPCR
01 ยีนแบบสอบถาม
โฮโม GAS6ผ่าน NCBIในที่นี้เราควรให้ความสนใจกับการเปรียบเทียบชื่อยีนและสายพันธุ์เพื่อให้แน่ใจว่าสอดคล้องกัน
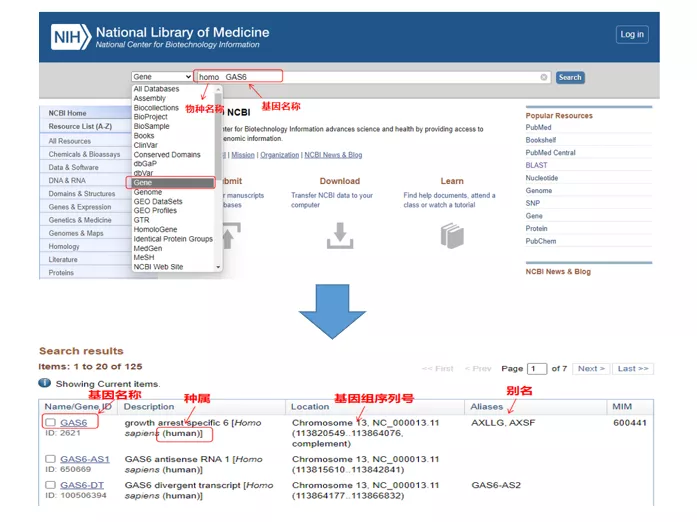 02 ค้นหาลำดับยีน
02 ค้นหาลำดับยีน
(1) หากลำดับเป้าหมายคือ DNA ของจีโนม ให้เลือกลำดับแรกซึ่งเป็นลำดับ DNA ของจีโนมของยีน
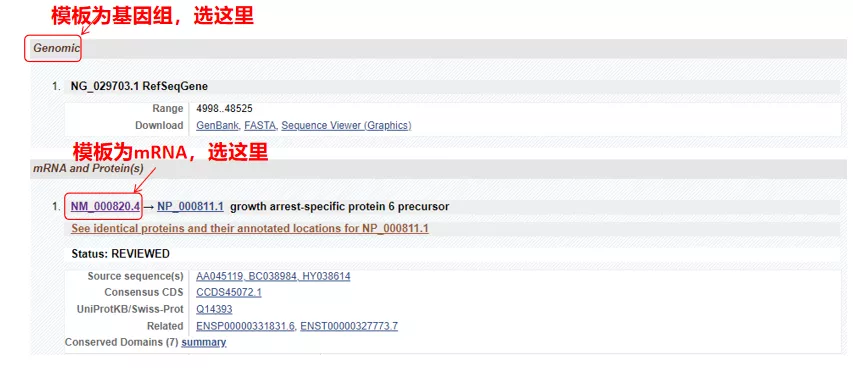 (2) หากลำดับเป้าหมายคือ mRNA ให้เลือกลำดับที่สองเมื่อเข้าไปแล้ว ให้คลิก “ซีดี” ในตารางด้านล่างลำดับพื้นหลังสีน้ำตาลคือลำดับการเข้ารหัสของยีน
(2) หากลำดับเป้าหมายคือ mRNA ให้เลือกลำดับที่สองเมื่อเข้าไปแล้ว ให้คลิก “ซีดี” ในตารางด้านล่างลำดับพื้นหลังสีน้ำตาลคือลำดับการเข้ารหัสของยีน
 03 ออกแบบไพรเมอร์
03 ออกแบบไพรเมอร์
เข้าสู่อินเทอร์เฟซ Primer-BLAST
 ป้อนหมายเลขลำดับยีนหรือลำดับในรูปแบบ Fasta ที่ด้านบนซ้าย และกรอกพารามิเตอร์ที่เกี่ยวข้อง
ป้อนหมายเลขลำดับยีนหรือลำดับในรูปแบบ Fasta ที่ด้านบนซ้าย และกรอกพารามิเตอร์ที่เกี่ยวข้อง
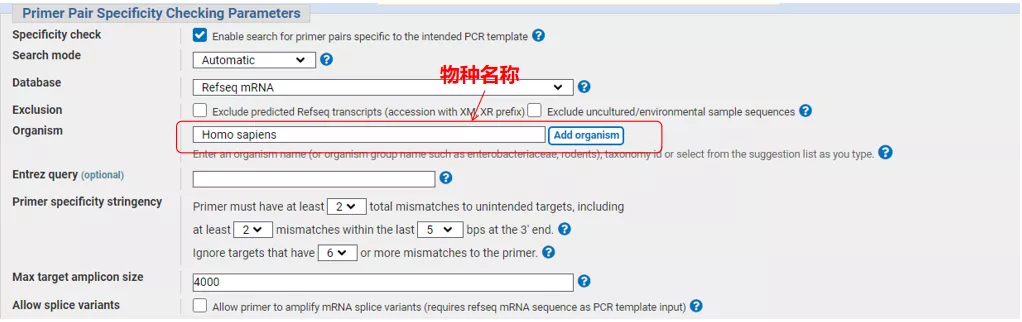
คลิก “รับไพรเมอร์” และ NCBI จะปรากฏขึ้นเพื่อแจ้งให้คุณทราบว่าการเลือกพารามิเตอร์ดังกล่าวจะถูกขยายไปยังตัวแปรการประกบอื่นๆเราสามารถตรวจสอบตัวเลือกการประกบที่แตกต่างกันและส่งพวกเขาเพื่อให้ได้คู่ไพรเมอร์ที่เหมาะสม (ดังแสดงในรูปด้านล่าง)กระบวนการนี้อาจใช้เวลาหลายสิบวินาทีในการทำงาน
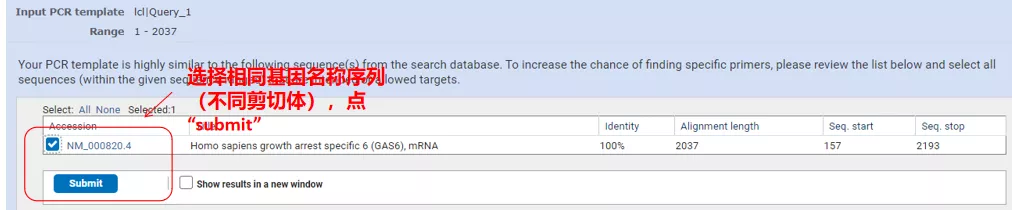
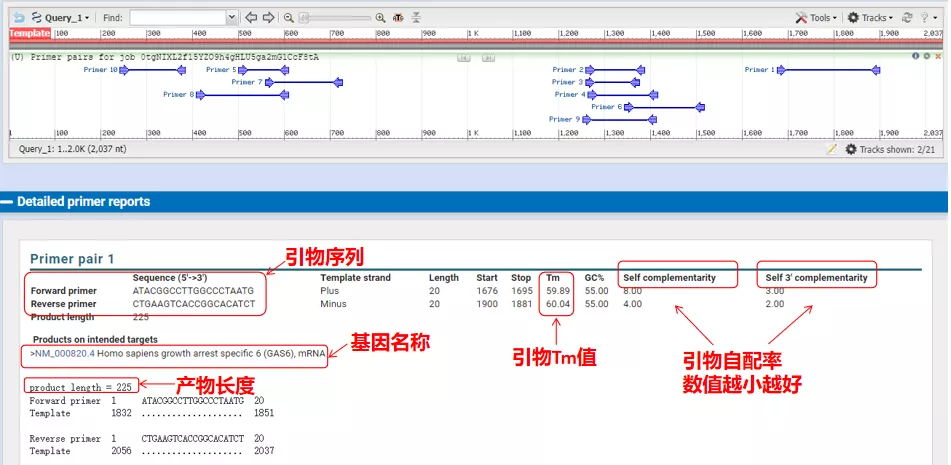 อุณหภูมิการหลอมของคู่ไพรเมอร์เหล่านี้อยู่ที่ประมาณ 60°Cตามวัตถุประสงค์ของการทดลอง เลือกไพรเมอร์ที่มีความยาวปานกลาง ความจำเพาะที่ดี และการเติมสีรองพื้นด้วยตัวเองน้อยกว่าสำหรับการทดลอง และอัตราความสำเร็จค่อนข้างสูง!
อุณหภูมิการหลอมของคู่ไพรเมอร์เหล่านี้อยู่ที่ประมาณ 60°Cตามวัตถุประสงค์ของการทดลอง เลือกไพรเมอร์ที่มีความยาวปานกลาง ความจำเพาะที่ดี และการเติมสีรองพื้นด้วยตัวเองน้อยกว่าสำหรับการทดลอง และอัตราความสำเร็จค่อนข้างสูง!
04การตรวจสอบความจำเพาะของสีรองพื้น
ในความเป็นจริง นอกจากการออกแบบไพรเมอร์แล้ว Primer-Blast ยังสามารถประเมินไพรเมอร์ที่เราออกแบบเองได้อีกด้วยกลับไปที่หน้าการออกแบบไพรเมอร์ ป้อนไพรเมอร์ต้นน้ำและปลายน้ำที่เราออกแบบ และพารามิเตอร์อื่นๆ จะไม่ได้รับการปรับหลังจากส่งแล้ว คุณสามารถดูได้ว่าคู่ของไพรเมอร์มีอยู่บนยีนอื่นด้วยหรือไม่หากแสดงทั้งหมดบนยีนที่เราต้องการขยาย แสดงว่าความจำเพาะของไพรเมอร์คู่นี้ดีมาก!(ตัวอย่างเช่น นี่เป็นผลลัพธ์เดียวของการสืบค้นไพรเมอร์!)
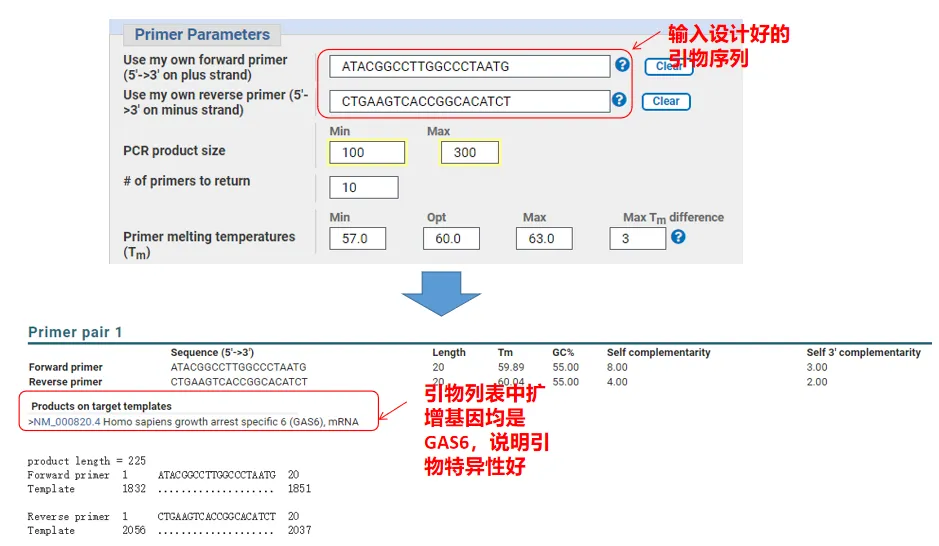
05 การตัดสินคุณภาพสีรองพื้น
ไพรเมอร์ประเภทใดคือไพรเมอร์ที่ “สมบูรณ์แบบ” ที่รวมเอา “ประสิทธิภาพการขยายสัญญาณตามมาตรฐาน” “คุณลักษณะของผลิตภัณฑ์ที่ขยายใหญ่ขึ้น” และ “ผลการทดลองที่เชื่อถือได้”
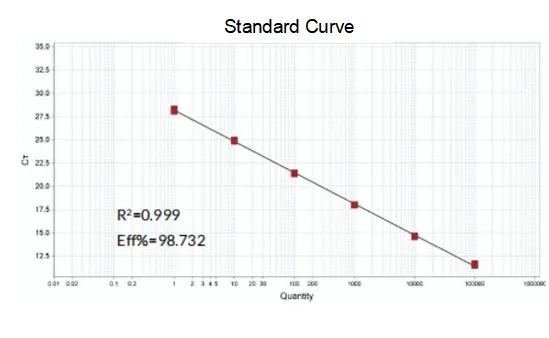 ประสิทธิภาพการขยาย
ประสิทธิภาพการขยาย
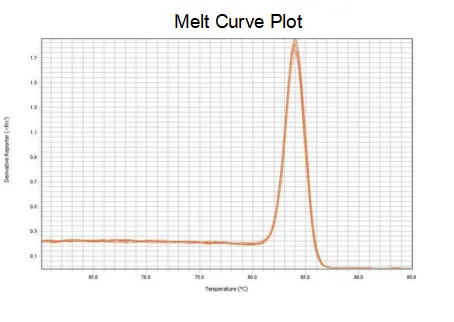 เส้นโค้งการละลาย
เส้นโค้งการละลาย
ประสิทธิภาพการขยายของไพรเมอร์ถึง 90%-110% ซึ่งหมายความว่าประสิทธิภาพการขยายนั้นดี และเส้นโค้งการหลอมละลายมีจุดสูงสุดเดียวและโดยปกติคือ Tm>80°C ซึ่งหมายความว่าความจำเพาะในการขยายนั้นดี
สินค้าที่เกี่ยวข้อง:
Real Time PCR Easy–SYBR GREEN I
PCR แบบเรียลไทม์ Easy-Taqman
เวลาโพสต์: ก.พ.-10-2566








