แอนติบอดีหรือที่เรียกว่าอิมมูโนโกลบูลิน (Ig) เป็นไกลโคโปรตีนที่จับกับแอนติเจนโดยเฉพาะ
การเตรียมแอนติบอดีแบบดั้งเดิมผลิตโดยการสร้างภูมิคุ้มกันให้กับสัตว์และการเก็บแอนติซีรัมดังนั้น antiserum มักจะมีแอนติบอดีต่อต้านแอนติเจนอื่น ๆ ที่ไม่เกี่ยวข้องและส่วนประกอบโปรตีนอื่น ๆ ในซีรั่มโมเลกุลของแอนติเจนทั่วไปส่วนใหญ่ประกอบด้วยอีพิโทปที่แตกต่างกันหลายตัว ดังนั้น แอนติบอดีทั่วไปจึงเป็นส่วนผสมของแอนติบอดีต่ออีพิโทปที่แตกต่างกันหลายตัวแม้แต่แอนติบอดีในซีรั่มทั่วไปที่มุ่งต่อต้านอีพิโทปเดียวกันก็ยังประกอบด้วยแอนติบอดีต่างกันที่ผลิตโดยโคลนเซลล์ B ที่แตกต่างกันดังนั้นแอนติบอดีในซีรั่มทั่วไปจึงเรียกอีกอย่างว่าโพลีโคลนอลแอนติบอดีหรือเรียกสั้นๆ ว่าโพลีโคลนอลแอนติบอดี
โมโนโคลนอล แอนติบอดี (โมโนโคลนอล แอนติบอดี) เป็นแอนติบอดีที่มีความสม่ำเสมอสูงซึ่งผลิตโดยโคลนเซลล์บีเซลล์เดียวและมุ่งสู่อีพิโทปที่จำเพาะเท่านั้นโดยปกติแล้วจะถูกเตรียมโดยเทคโนโลยีไฮบริโดมา—เทคโนโลยีแอนติบอดีของไฮบริโดมาขึ้นอยู่กับเทคโนโลยีการหลอมรวมเซลล์ ซึ่งรวมเซลล์บีที่มีความสามารถในการหลั่งแอนติบอดีจำเพาะและเซลล์มัยอีโลมาที่มีความสามารถในการเติบโตไม่สิ้นสุดเป็นบีเซลล์ไฮบริโดมาเซลล์ไฮบริโดมานี้มีลักษณะเฉพาะของเซลล์แม่มันสามารถเพิ่มจำนวนได้อย่างไม่จำกัดและเป็นอมตะในหลอดทดลอง เช่น เซลล์มัยอีโลมา และสามารถสังเคราะห์และหลั่งแอนติบอดีจำเพาะ เช่น เซลล์เม็ดเลือดขาวม้ามโตโดยผ่านการโคลนนิ่ง สามารถรับสายโมโนโคลนอลที่ได้มาจากเซลล์ไฮบริโดมาเซลล์เดียว นั่นคือ สายเซลล์ไฮบริโดมาแอนติบอดีที่ผลิตขึ้นนั้นเป็นแอนติบอดีที่เป็นเนื้อเดียวกันสูงต่อแอนติเจนดีเทอร์มิแนนต์เดียวกัน นั่นคือ โมโนโคลนอลแอนติบอดี
แอนติบอดีมีอยู่เป็นโมโนเมอร์รูปตัว Y หนึ่งตัวหรือมากกว่า (กล่าวคือ โมโนโคลนอลแอนติบอดีหรือโพลีโคลนัลแอนติบอดี)มอนอเมอร์รูปตัว Y แต่ละตัวประกอบด้วยสายโพลีเปปไทด์ 4 สาย ซึ่งรวมถึงสายหนักที่เหมือนกันสองสายและสายเบาที่เหมือนกันสองสายสายเบาและสายหนักตั้งชื่อตามน้ำหนักโมเลกุลส่วนบนสุดของโครงสร้างรูปตัว Y คือบริเวณที่แปรผันได้ ซึ่งเป็นบริเวณที่จับกับแอนติเจน(ตัดตอนมาจากแนวคิด Detai Bio-Monoclonal Antibody)
โครงสร้างแอนติบอดี
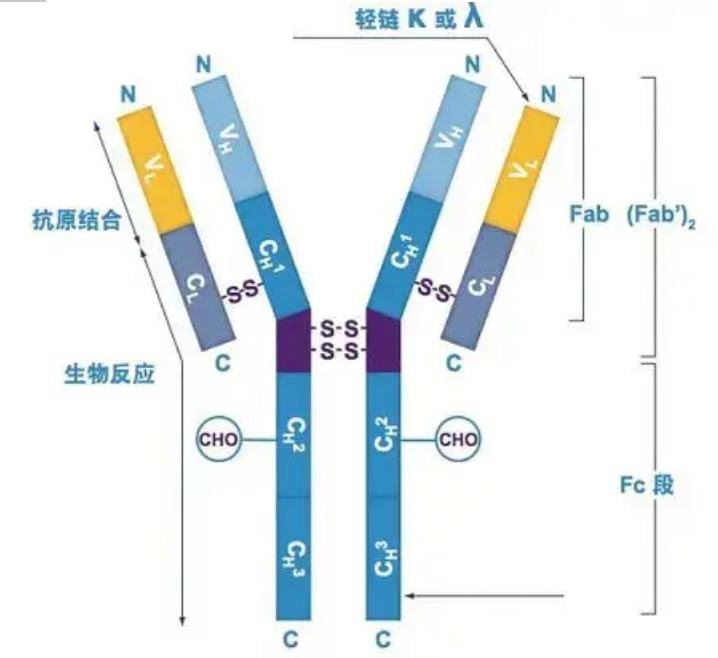 โซ่หนัก
โซ่หนัก
โซ่หนัก Ig ของสัตว์เลี้ยงลูกด้วยนมมีห้าประเภท ตั้งชื่อตามตัวอักษรกรีก α, δ, ε, γ และ μแอนติบอดีที่เกี่ยวข้องเรียกว่า IgA, IgD, IgE, IgG และ IgMโซ่หนักที่แตกต่างกันมีขนาดและองค์ประกอบต่างกันα และ γ มีกรดอะมิโนประมาณ 450 ตัว ในขณะที่ μ และ ε มีกรดอะมิโนประมาณ 550 ตัว
สายหนักแต่ละเส้นมีสองบริเวณ: บริเวณคงที่และบริเวณแปรผันแอนติบอดีประเภทเดียวกันทั้งหมดมีพื้นที่คงที่เหมือนกัน แต่มีความแตกต่างระหว่างแอนติบอดีประเภทต่างๆบริเวณคงที่ของสายหนัก γ, α และ δ ประกอบด้วยโดเมน Ig สามโดเมนเรียงตามกัน โดยมีบริเวณบานพับเพื่อเพิ่มความยืดหยุ่น;บริเวณคงที่ของสายหนัก μ และ ε ประกอบด้วยโดเมน Ig 4 โดเมนบริเวณที่แปรผันได้ของสายหนักของแอนติบอดีที่ผลิตโดยเซลล์ B ที่แตกต่างกันนั้นแตกต่างกัน แต่บริเวณที่แปรผันได้ของแอนติบอดีที่ผลิตโดยเซลล์ B เดียวกันหรือโคลนเซลล์เหมือนกัน และบริเวณที่แปรผันได้ของสายหนักแต่ละเส้นมีความยาวประมาณ 110 กรดอะมิโนและสร้างโดเมน Ig เดียว
โซ่ไฟ
มีสายเบาเพียงสองประเภทในสัตว์เลี้ยงลูกด้วยนม: ประเภทแลมบ์ดาและประเภทแคปปาแต่ละสายเบามีสองโดเมนที่เชื่อมโยง: บริเวณคงที่และบริเวณแปรผันความยาวของสายเบาคือประมาณ 211~217 กรดอะมิโนสายเบาสองสายที่มีอยู่ในแอนติบอดีแต่ละตัวจะเหมือนกันเสมอสำหรับสัตว์เลี้ยงลูกด้วยนม สายเบาในแอนติบอดีแต่ละตัวมีเพียงชนิดเดียว: แคปปาหรือแลมบ์ดาในสัตว์มีกระดูกสันหลังส่วนล่างบางชนิด เช่น ปลากระดูกอ่อน (ปลากระดูกอ่อน) และปลากระดูกแข็ง ยังพบสายเบาประเภทอื่นๆ เช่น ประเภทไอโอตา (iota) อีกด้วย
ส่วน Fab และ Fc
ส่วน Fc สามารถรวมกันโดยตรงกับเอนไซม์หรือสีย้อมเรืองแสงเพื่อติดฉลากแอนติบอดีเป็นส่วนที่หมุดย้ำแอนติบอดีบนจานระหว่างกระบวนการ ELISA และยังเป็นส่วนที่จดจำแอนติบอดีตัวที่สองและจับกันในการกระตุ้นภูมิคุ้มกัน การกระตุ้นภูมิคุ้มกัน และเคมีอิมมูโนแอนติบอดีสามารถถูกไฮโดรไลซ์ออกเป็นสองส่วน F(ab) และหนึ่งส่วน Fc โดยเอนไซม์ย่อยโปรตีน เช่น ปาเปน หรือพวกมันสามารถถูกทำให้แตกออกจากบริเวณบานพับโดยเพปซินและไฮโดรไลซ์เป็นส่วน F(ab)2 หนึ่งส่วนและหนึ่งส่วน Fcชิ้นส่วนแอนติบอดี IgG บางครั้งมีประโยชน์มากเนื่องจากไม่มีส่วน Fc ส่วน F (ab) จะไม่ตกตะกอนกับแอนติเจน และจะไม่ถูกจับโดยเซลล์ภูมิคุ้มกันในการศึกษาในร่างกายเนื่องจากชิ้นส่วนโมเลกุลขนาดเล็กและขาดฟังก์ชันการเชื่อมโยงข้าม (เนื่องจากไม่มีส่วน Fc) ส่วน Fab มักจะใช้สำหรับการติดฉลากด้วยรังสีในการศึกษาการทำงาน และส่วน Fc ส่วนใหญ่จะใช้เป็นสารปิดกั้นในการย้อมสีฮิสโตเคมี
ภูมิภาคที่แปรผันและคงที่
บริเวณที่แปรผันได้ (บริเวณ V) ตั้งอยู่ที่ 1/5 หรือ 1/4 (ซึ่งมีเรซิดิวกรดอะมิโนประมาณ 118 ตัว) ของสาย H ใกล้กับปลาย N และ 1/2 (ซึ่งมีเรซิดิวกรดอะมิโนประมาณ 108-111 ตัว) ใกล้กับปลาย N ของสาย Lบริเวณ V แต่ละบริเวณมีวงแหวนเปปไทด์ที่เกิดจากพันธะไดซัลไฟด์ภายในสายโซ่ และวงแหวนเพปไทด์แต่ละวงแหวนมีกรดอะมิโนตกค้างประมาณ 67 ถึง 75 ตัวองค์ประกอบและการจัดเรียงตัวของกรดอะมิโนในบริเวณ V เป็นตัวกำหนดความจำเพาะในการจับแอนติเจนของแอนติบอดีเนื่องจากชนิดและลำดับของกรดอะมิโนที่เปลี่ยนแปลงตลอดเวลาในบริเวณ V จึงสามารถก่อรูปแอนติบอดีหลายชนิดที่มีความจำเพาะต่อแอนติเจนที่จับต่างกันได้บริเวณ V ของสาย L และสาย H เรียกว่า VL และ VH ตามลำดับใน VL และ VH องค์ประกอบกรดอะมิโนและลำดับของบริเวณเฉพาะที่บางแห่งมีระดับการแปรผันที่สูงกว่าภูมิภาคเหล่านี้เรียกว่าภูมิภาคที่มีความแปรปรวนสูง (HVR)องค์ประกอบกรดอะมิโนและการจัดเรียงของส่วนที่ไม่ใช่ HVR ในบริเวณ V นั้นค่อนข้างอนุรักษ์นิยม ซึ่งเรียกว่าบริเวณเฟรมเวิร์กมีบริเวณที่มีความแปรผันสูงสามบริเวณใน VL ซึ่งโดยปกติจะอยู่ที่เรซิดิวของกรดอะมิโน 24 ถึง 34 และ 89 ถึง 97 ตามลำดับHVR สามตัวของ VL และ VH เรียกว่า HVR1, HVR2 และ HVR3 ตามลำดับการวิจัยและการวิเคราะห์ X-ray crystal diffraction พิสูจน์ให้เห็นว่าบริเวณที่แปรผันได้สูงนั้นเป็นจุดที่แอนติบอดีจับกับแอนติบอดี ดังนั้นจึงเรียกว่าบริเวณกำหนดส่วนเติมเต็ม (CDR)HVR1, HVR2 และ HVR3 ของ VL และ VH สามารถเรียกว่า CDR1, CDR2 และ CDR3 ตามลำดับโดยทั่วไป CDR3 มีระดับความแปรปรวนสูงที่สูงกว่าภูมิภาคที่มีความแปรปรวนสูงยังเป็นตำแหน่งหลักที่มีปัจจัยที่แปลกประหลาดของโมเลกุล Ig อยู่ในกรณีส่วนใหญ่ สาย H มีบทบาทสำคัญในการจับกับแอนติเจน
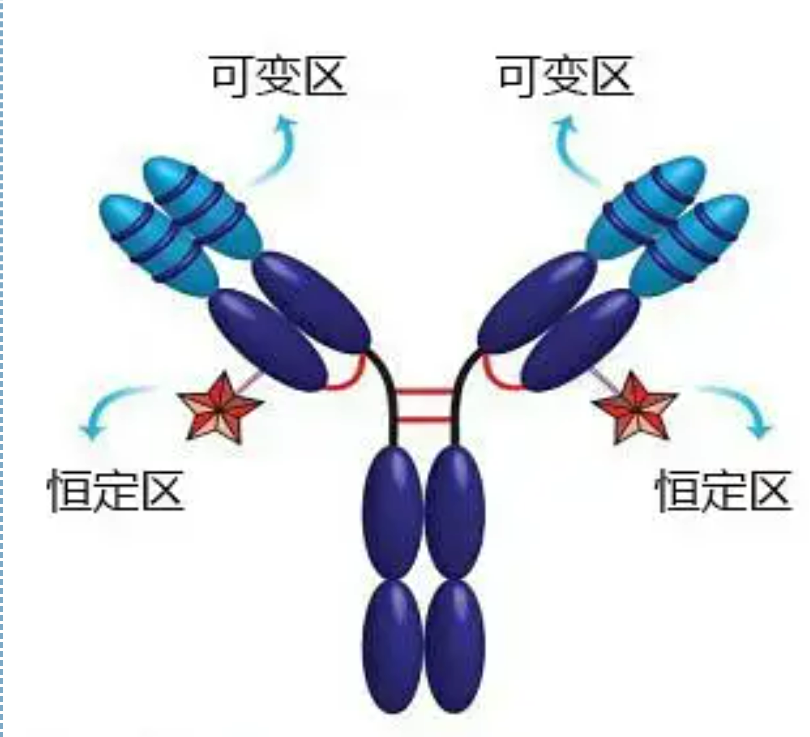 ภูมิภาคคงที่ (ภูมิภาค C)ตั้งอยู่ที่ 3/4 หรือ 4/5 (โดยประมาณจากกรดอะมิโน 119 ถึงปลาย C) ของสาย H ใกล้ปลาย C และ 1/2 (ประกอบด้วยเรซิดิวกรดอะมิโนประมาณ 105 ตัว) ใกล้ปลาย C ของสาย Lแต่ละขอบเขตการทำงานของสายโซ่ H ประกอบด้วยเรซิดิวของกรดอะมิโนประมาณ 110 ตัว และมีวงแหวนเพปไทด์ที่ประกอบด้วยเรซิดิวกรดอะมิโน 50-60 ตัวที่เชื่อมกันด้วยพันธะไดซัลไฟด์องค์ประกอบกรดอะมิโนและการจัดเรียงตัวของบริเวณนี้ค่อนข้างคงที่ในสายโซ่ Ig ไอโซไทป์ L ของสัตว์ชนิดเดียวกันและสาย H ประเภทเดียวกันเช่นเดียวกันมันสามารถจับกับแอนติเจนที่สอดคล้องกันโดยเฉพาะ แต่โครงสร้างของบริเวณ C นั้นเหมือนกันนั่นคือมีแอนติเจนเหมือนกันแอนติบอดีทุติยภูมิ IgG ที่ต่อต้านม้าของมนุษย์ (หรือแอนติบอดี) สามารถรวมกับแอนติบอดี A (IgG) สองตัวที่ต้านพิษที่ต่างกันได้นี่เป็นพื้นฐานที่สำคัญสำหรับการเตรียมแอนติบอดีทุติยภูมิและการใช้ฟลูออเรสซิน ไอโซโทป เอนไซม์ และแอนติบอดีที่มีฉลากอื่นๆ
ภูมิภาคคงที่ (ภูมิภาค C)ตั้งอยู่ที่ 3/4 หรือ 4/5 (โดยประมาณจากกรดอะมิโน 119 ถึงปลาย C) ของสาย H ใกล้ปลาย C และ 1/2 (ประกอบด้วยเรซิดิวกรดอะมิโนประมาณ 105 ตัว) ใกล้ปลาย C ของสาย Lแต่ละขอบเขตการทำงานของสายโซ่ H ประกอบด้วยเรซิดิวของกรดอะมิโนประมาณ 110 ตัว และมีวงแหวนเพปไทด์ที่ประกอบด้วยเรซิดิวกรดอะมิโน 50-60 ตัวที่เชื่อมกันด้วยพันธะไดซัลไฟด์องค์ประกอบกรดอะมิโนและการจัดเรียงตัวของบริเวณนี้ค่อนข้างคงที่ในสายโซ่ Ig ไอโซไทป์ L ของสัตว์ชนิดเดียวกันและสาย H ประเภทเดียวกันเช่นเดียวกันมันสามารถจับกับแอนติเจนที่สอดคล้องกันโดยเฉพาะ แต่โครงสร้างของบริเวณ C นั้นเหมือนกันนั่นคือมีแอนติเจนเหมือนกันแอนติบอดีทุติยภูมิ IgG ที่ต่อต้านม้าของมนุษย์ (หรือแอนติบอดี) สามารถรวมกับแอนติบอดี A (IgG) สองตัวที่ต้านพิษที่ต่างกันได้นี่เป็นพื้นฐานที่สำคัญสำหรับการเตรียมแอนติบอดีทุติยภูมิและการใช้ฟลูออเรสซิน ไอโซโทป เอนไซม์ และแอนติบอดีที่มีฉลากอื่นๆ
สินค้าที่เกี่ยวข้อง:
ชุด Cell Direct RT-qPCR
เวลาโพสต์: กันยายน 30-2021








