ในฐานะที่เป็นพืชใหม่ในห้องปฏิบัติการ การคัดแยกพืชที่เป็นบวกออกจากกลุ่มพืชที่มีอัตราการเปลี่ยนแปลงต่ำไม่ใช่งานที่ดีประการแรก ต้องสกัด DNA จากตัวอย่างจำนวนมากทีละตัวอย่าง จากนั้นจึงตรวจหายีนแปลกปลอมด้วย PCRอย่างไรก็ตาม ผลลัพธ์มักจะเป็นช่องว่างและแถบที่มีบางรายการในบางครั้ง แต่ไม่สามารถระบุได้ว่ามีการตรวจจับที่พลาดหรือการตรวจจับที่ผิดพลาด.การเผชิญหน้ากับกระบวนการทดลองและผลลัพธ์เช่นนี้ช่วยอะไรไม่ได้มากหรือ?ไม่ต้องกังวล พี่ชายจะสอนวิธีคัดพืชดัดแปลงพันธุกรรมอย่างง่ายดายและแม่นยำ
ขั้นตอนที่ 1
ออกแบบไพรเมอร์ตรวจจับ
ตรวจสอบยีนภายนอกและยีนภายนอกที่จะตรวจพบตามตัวอย่างที่จะทดสอบ และเลือกลำดับ 100-500bp ที่เป็นตัวแทนในยีนสำหรับการออกแบบไพรเมอร์ไพรเมอร์ที่ดีสามารถรับประกันความถูกต้องของผลการตรวจจับและลดระยะเวลาการตรวจจับ (ดูภาคผนวกสำหรับไพรเมอร์การตรวจจับที่ใช้กันทั่วไป)
หมายเหตุ: ไพรเมอร์ที่ออกแบบใหม่จำเป็นต้องปรับสภาวะการเกิดปฏิกิริยาให้เหมาะสมและตรวจสอบความถูกต้อง ความแม่นยำ และขีดจำกัดการตรวจจับของการตรวจจับก่อนการตรวจจับขนาดใหญ่
ขั้นตอนที่ 2
ออกแบบโปรโตคอลการทดลอง
การควบคุมเชิงบวก: ใช้ DNA บริสุทธิ์ที่มีชิ้นส่วนเป้าหมายเป็นแม่แบบเพื่อตรวจสอบว่าระบบปฏิกิริยาและเงื่อนไขของ PCR เป็นปกติหรือไม่
การควบคุมเชิงลบ/ว่าง: ใช้เทมเพลต DNA หรือ ddH2O ที่ไม่มีชิ้นส่วนเป้าหมายเป็นเทมเพลตเพื่อตรวจสอบว่ามีแหล่งที่มาของการปนเปื้อนในระบบ PCR หรือไม่
การควบคุมอ้างอิงภายใน: ใช้การผสมไพรเมอร์/โพรบของยีนภายนอกของตัวอย่างที่จะทดสอบเพื่อประเมินว่า PCR สามารถตรวจจับแม่แบบได้หรือไม่
สังเกต:
ควรมีการตั้งค่าการควบคุมเชิงบวก ลบ/ว่าง และการควบคุมภายในสำหรับการทดสอบแต่ละครั้งเพื่อประเมินความถูกต้องของผลการทดลอง
การเตรียมการทดลอง
ก่อนใช้ให้สังเกตว่าผสมสารละลายอย่างสม่ำเสมอหรือไม่หากพบฝนต้องละลายและผสมตามคำแนะนำก่อนใช้ต้องปิเปตผสม 2×PCR และผสมซ้ำกับไมโครปิเปตก่อนใช้งานเพื่อหลีกเลี่ยงการกระจายไอออนที่ไม่สม่ำเสมอ
สังเกต:
นำคู่มือออกมาอ่านอย่างละเอียดและเตรียมการก่อนการทดลองตามข้อกำหนดของคู่มืออย่างเคร่งครัด
ขั้นตอนที่ 4
เตรียมระบบปฏิกิริยา PCR
ตามระเบียบการทดลอง ผสมไพรเมอร์ H2O และ 2×PCR ผสมเท่าๆ กัน หมุนเหวี่ยงและกระจายไปยังหลอดปฏิกิริยาแต่ละหลอด
สังเกต:
สำหรับการทดสอบขนาดใหญ่หรือระยะยาว ขอแนะนำให้ใช้ระบบปฏิกิริยา PCR ที่มีเอนไซม์ UNG ซึ่งสามารถหลีกเลี่ยงการปนเปื้อนละอองที่เกิดจากผลิตภัณฑ์ PCR ได้อย่างมีประสิทธิภาพ
ขั้นตอนที่ 5
เพิ่มเทมเพลตปฏิกิริยา
การใช้เทคโนโลยี Direct PCR ทำให้ไม่จำเป็นต้องมีกระบวนการทำให้บริสุทธิ์ด้วยกรดนิวคลีอิกที่น่าเบื่อ สามารถเตรียมแม่แบบตัวอย่างได้ภายใน 10 นาที และสามารถเพิ่มระบบปฏิกิริยา PCR ที่สอดคล้องกันได้
สังเกต:
วิธีการตัดแยกมีผลการตรวจจับที่ดีกว่า และผลิตภัณฑ์ที่ได้รับสามารถใช้สำหรับปฏิกิริยาการตรวจจับหลายครั้ง
5.1: การขยายใบโดยตรง
ตามขนาดรูปภาพในคู่มือ ตัดเนื้อเยื่อใบที่มีเส้นผ่านศูนย์กลาง 2-3 มม. แล้ววางในระบบปฏิกิริยา PCR
หมายเหตุ: ตรวจสอบให้แน่ใจว่าเศษใบไม้แช่อยู่ในสารละลายปฏิกิริยา PCR อย่างสมบูรณ์ และอย่าเพิ่มเนื้อเยื่อใบไม้มากเกินไป
5.2: วิธีการแตกใบ
ตัดเนื้อเยื่อใบที่มีเส้นผ่านศูนย์กลาง 5-7 มม. แล้วใส่ลงในหลอดปั่นแยกหากคุณเลือกใบแก่ โปรดหลีกเลี่ยงการใช้เนื้อเยื่อของเส้นเลือดหลักของใบปิเปต 50ul Buffer P1 ไลเซทในหลอดปั่นแยกเพื่อให้แน่ใจว่าไลเซทสามารถแช่เนื้อเยื่อใบได้อย่างสมบูรณ์ วางไว้ในเครื่องหมุนเวียนความร้อนหรืออ่างโลหะ และไลเซทที่อุณหภูมิ 95°C เป็นเวลา 5-10 นาที
เติมสารละลายที่ทำให้เป็นกลาง 50ul Buffer P2 และผสมให้เข้ากันไลเซทที่เป็นผลลัพธ์สามารถใช้เป็นแม่แบบและเพิ่มลงในระบบปฏิกิริยา PCR
หมายเหตุ: จำนวนแม่แบบอยู่ระหว่าง 5-10% ของระบบ PCR และไม่ควรเกิน 20% (ตัวอย่างเช่น ในระบบ PCR 20μl ให้เติมสารละลาย lysis 1-2μl ไม่เกิน 4μl)
ขั้นตอนที่ 6
ปฏิกิริยาพีซีอาร์
หลังจากการปั่นแยกหลอดปฏิกิริยา PCR จะถูกใส่ในอุปกรณ์ PCR เพื่อขยาย
สังเกต:
ปฏิกิริยานี้ใช้แม่แบบที่ไม่ผ่านการทำให้บริสุทธิ์สำหรับการขยาย ดังนั้นจำนวนรอบของการขยายจึงมากกว่า 5-10 รอบกว่าเมื่อใช้แม่แบบ DNA ที่บริสุทธิ์
ขั้นตอนที่ 7
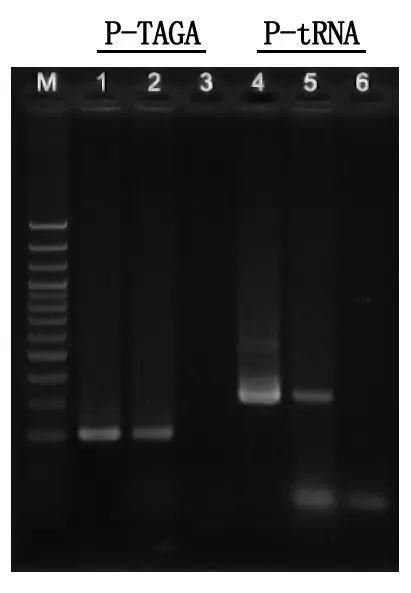
การตรวจจับอิเล็กโทรโฟรีซิสและการวิเคราะห์ผลลัพธ์
M: บันไดดีเอ็นเอ 100bp
1\4: วิธีการทำให้บริสุทธิ์ของ DNA
2\5: วิธี PCR โดยตรง
3\6: การควบคุมว่าง
ควบคุมคุณภาพ:
ผลการทดสอบชุดควบคุมต่างๆ ในการทดลอง ควรเป็นไปตามเงื่อนไขต่อไปนี้มิฉะนั้น ควรวิเคราะห์สาเหตุของปัญหา และควรทำการทดสอบอีกครั้งหลังจากกำจัดปัญหาได้แล้ว
ตารางที่ 1 ผลการทดสอบปกติของกลุ่มควบคุมต่างๆ
*เมื่อใช้พลาสมิดเป็นตัวควบคุมเชิงบวก ผลการทดสอบยีนภายนอกอาจเป็นลบ
ผลการตัดสิน:
A. ผลการทดสอบยีนภายนอกของตัวอย่างมีค่าเป็นลบ ซึ่งบ่งชี้ว่าไม่สามารถสกัด DNA ที่เหมาะสมสำหรับการตรวจ PCR ธรรมดาออกจากตัวอย่างได้ หรือ DNA ที่สกัดได้มีสารยับยั้งปฏิกิริยา PCR และควรสกัด DNA อีกครั้ง
B. ผลการทดสอบยีนภายนอกของตัวอย่างเป็นบวก และผลการทดสอบของยีนภายนอกเป็นลบ ซึ่งบ่งชี้ว่า DNA ที่เหมาะสมสำหรับการตรวจหา PCR ทั่วไปนั้นถูกดึงออกมาจากตัวอย่าง และสามารถตัดสินได้ว่าไม่พบยีน XXX ในตัวอย่าง
C. ผลการทดสอบยีนภายนอกของตัวอย่างเป็นบวก และผลการทดสอบของยีนภายนอกเป็นบวก ซึ่งบ่งชี้ว่า DNA ที่เหมาะสมสำหรับการตรวจหา PCR ทั่วไปได้รับการสกัดจากตัวอย่าง และ DNA ตัวอย่างมียีน XXXสามารถทำการทดลองยืนยันต่อไปได้
ขั้นตอนที่ 8
ออกแบบไพรเมอร์ตรวจจับ
หลังการทดลอง ใช้สารละลายโซเดียมไฮโปคลอไรต์ 2% และสารละลายเอทานอล 70% เช็ดพื้นที่ทดลองเพื่อป้องกันมลภาวะต่อสิ่งแวดล้อม。
เวลาโพสต์: Sep-08-2021