เทคโนโลยีการวินิจฉัยระดับโมเลกุลใช้วิธีทางอณูชีววิทยาเพื่อตรวจหาการแสดงออกและโครงสร้างของสารพันธุกรรมของร่างกายมนุษย์และเชื้อโรคต่างๆ เพื่อให้บรรลุวัตถุประสงค์ในการทำนายและวินิจฉัยโรค
ในช่วงไม่กี่ปีที่ผ่านมา ด้วยการยกระดับและการทำซ้ำของเทคโนโลยีการวินิจฉัยระดับโมเลกุล การประยุกต์ใช้ทางคลินิกของการวินิจฉัยระดับโมเลกุลจึงมีความกว้างขวางและเจาะลึกมากขึ้น และตลาดการวินิจฉัยระดับโมเลกุลได้เข้าสู่ช่วงของการพัฒนาอย่างรวดเร็ว
ผู้เขียนสรุปเทคโนโลยีการวินิจฉัยระดับโมเลกุลทั่วไปในท้องตลาด และแบ่งออกเป็นสามส่วน: ส่วนแรกแนะนำเทคโนโลยี PCR ส่วนที่สองแนะนำเทคโนโลยีการขยายความร้อนด้วยความร้อนของกรดนิวคลีอิก และส่วนที่สองแนะนำเทคโนโลยีการหาลำดับ
01
ส่วนที่ 1: เทคโนโลยี PCR
เทคโนโลยีพีซีอาร์
PCR (ปฏิกิริยาลูกโซ่โพลีเมอเรส) เป็นหนึ่งในเทคโนโลยีการขยาย DNA ในหลอดทดลองที่มีประวัติยาวนานกว่า 30 ปี
เทคโนโลยี PCR ได้รับการบุกเบิกในปี 1983 โดย Kary Mullis แห่ง Cetus ประเทศสหรัฐอเมริกามัลลิสยื่นขอสิทธิบัตร PCR ในปี 1985 และตีพิมพ์บทความวิชาการ PCR ฉบับแรกเกี่ยวกับวิทยาศาสตร์ในปีเดียวกันมัลลิสได้รับรางวัลโนเบลสาขาเคมีในปี 2536
หลักการพื้นฐานของ PCR
PCR สามารถขยายชิ้นส่วน DNA เป้าหมายได้มากกว่าหนึ่งล้านเท่าหลักการคือภายใต้การเร่งปฏิกิริยาของ DNA polymerase DNA สายแม่จะถูกใช้เป็นแม่แบบ และใช้ไพรเมอร์เฉพาะเป็นจุดเริ่มต้นสำหรับการขยายมีการทำซ้ำในหลอดทดลองผ่านขั้นตอนต่าง ๆ เช่น การสูญเสียสภาพธรรมชาติ การหลอม และการขยายกระบวนการของ DNA สายลูกสาวเสริมกับ DNA แม่แบบสายแม่
กระบวนการ PCR มาตรฐานแบ่งออกเป็นสามขั้นตอน:
1. การเสียสภาพธรรมชาติ: ใช้อุณหภูมิสูงเพื่อแยกสายคู่ของ DNAพันธะไฮโดรเจนระหว่างสายคู่ของ DNA จะถูกทำลายที่อุณหภูมิสูง (93-98°C)
2. การหลอม: หลังจากแยก DNA สายคู่แล้ว อุณหภูมิจะลดลงเพื่อให้ไพรเมอร์จับกับ DNA สายเดี่ยวได้
3. ส่วนขยาย: DNA polymerase เริ่มสังเคราะห์สายเสริมตามสาย DNA จากไพรเมอร์ที่จับกันเมื่ออุณหภูมิลดลงเมื่อการขยายเสร็จสิ้น วัฏจักรจะเสร็จสมบูรณ์ และจำนวนชิ้นส่วนของ DNA จะเพิ่มเป็นสองเท่า
การดำเนินการทั้งสามขั้นตอนนี้ซ้ำกัน 25-35 ครั้ง จำนวนชิ้นส่วน DNA จะเพิ่มขึ้นอย่างทวีคูณ
ความฉลาดของ PCR คือสามารถออกแบบไพรเมอร์ที่แตกต่างกันสำหรับยีนเป้าหมายที่แตกต่างกัน เพื่อให้สามารถขยายชิ้นส่วนของยีนเป้าหมายในช่วงเวลาสั้นๆ
จนถึงขณะนี้ PCR สามารถแบ่งออกได้เป็น 3 ประเภท ได้แก่ PCR ธรรมดา PCR เชิงปริมาณเรืองแสง และ PCR ดิจิทัล
PCR สามัญรุ่นแรก
ใช้เครื่องมือขยาย PCR ทั่วไปเพื่อขยายยีนเป้าหมาย จากนั้นใช้ agarose gel electrophoresis เพื่อตรวจจับผลิตภัณฑ์ ทำได้เฉพาะการวิเคราะห์เชิงคุณภาพเท่านั้น
ข้อเสียเปรียบหลักของ PCR รุ่นแรก:
- มีแนวโน้มที่จะขยายแบบไม่เฉพาะเจาะจงและผลบวกที่ผิดพลาด
- การตรวจจับใช้เวลานานและการดำเนินการยุ่งยาก
- การทดสอบเชิงคุณภาพสามารถทำได้เท่านั้น
PCR เชิงปริมาณเรืองแสงรุ่นที่สอง
PCR เชิงปริมาณฟลูออเรสเซนซ์ (Real-Time PCR) หรือที่เรียกว่า qPCR ใช้ในการตรวจสอบการสะสมของผลิตภัณฑ์ที่ขยายผ่านการสะสมของสัญญาณฟลูออเรสเซนต์โดยการเพิ่มหัววัดฟลูออเรสเซนต์ที่สามารถระบุความคืบหน้าของระบบปฏิกิริยา และตัดสินผลลัพธ์ผ่านเส้นโค้งเรืองแสง และสามารถหาปริมาณได้โดยใช้ค่า Cq และเส้นโค้งมาตรฐาน
เนื่องจากเทคโนโลยี qPCR ดำเนินการในระบบปิด ความน่าจะเป็นของการปนเปื้อนจึงลดลง และสามารถตรวจสอบสัญญาณเรืองแสงสำหรับการตรวจจับเชิงปริมาณได้ ดังนั้นจึงใช้กันอย่างแพร่หลายในการปฏิบัติทางคลินิกและกลายเป็นเทคโนโลยีที่โดดเด่นใน PCR
สารเรืองแสงที่ใช้ใน PCR เชิงปริมาณเรืองแสงตามเวลาจริงสามารถแบ่งออกเป็น: โพรบเรืองแสง TaqMan, สัญญาณบอกระดับโมเลกุล และสีย้อมเรืองแสง
1) หัววัดเรืองแสง TaqMan:
ในระหว่างการขยาย PCR จะมีการเพิ่มโพรบเรืองแสงเฉพาะในขณะที่เพิ่มไพรเมอร์หนึ่งคู่โพรบเป็นโอลิโกนิวคลีโอไทด์ และปลายทั้งสองด้านมีป้ายกำกับตามลำดับด้วยกลุ่มรีพอร์ตฟลูออเรสเซนต์และกลุ่มเควเชอร์ฟลูออเรสเซนต์
เมื่อโพรบไม่เสียหาย สัญญาณเรืองแสงที่ปล่อยออกมาจากกลุ่มนักข่าวจะถูกดูดซับโดยกลุ่มดับในระหว่างการขยาย PCR กิจกรรม exonuclease 5′-3′ ของเอนไซม์ Taq จะแยกและย่อยสลายโพรบ ทำให้กลุ่มเรืองแสงของนักข่าวและสารดับ กลุ่มเรืองแสงถูกแยกออกจากกัน เพื่อให้ระบบตรวจสอบการเรืองแสงสามารถรับสัญญาณเรืองแสงได้ นั่นคือทุกครั้งที่มีการขยายสาย DNA โมเลกุลเรืองแสงจะก่อตัวขึ้น และการสะสมของสัญญาณเรืองแสงจะประสานกับการก่อตัวของผลิตภัณฑ์ PCR อย่างสมบูรณ์
2) สีย้อมเรืองแสง SYBR:
ในระบบปฏิกิริยา PCR มีการเติมสีย้อมเรืองแสง SYBR ที่มากเกินไปหลังจากที่สีย้อมเรืองแสง SYBR ไม่ถูกรวมเข้ากับเส้นใยคู่ของ DNA อย่างเฉพาะเจาะจง มันจะส่งสัญญาณเรืองแสงโมเลกุลสีย้อม SYBR ที่ไม่ได้รวมอยู่ในสายโซ่จะไม่ปล่อยสัญญาณเรืองแสงใด ๆ ดังนั้นจึงมั่นใจได้ว่าสัญญาณเรืองแสง การเพิ่มขึ้นของผลิตภัณฑ์ PCR จะซิงโครไนซ์กับการเพิ่มขึ้นของผลิตภัณฑ์ PCR อย่างสมบูรณ์SYBR จับกับ DNA ที่มีเกลียวสองเส้นเท่านั้น ดังนั้นจึงสามารถใช้เส้นกราฟการหลอมเหลวเพื่อตรวจสอบว่าปฏิกิริยา PCR นั้นจำเพาะหรือไม่
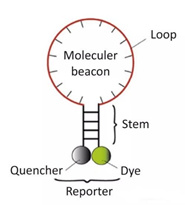
3) สัญญาณโมเลกุล
เป็นโพรบโอลิโกนิวคลีโอไทด์ที่มีฉลากติดฉลากสองครั้งที่ก้านซึ่งสร้างโครงสร้างกิ๊บประมาณ 8 ฐานที่ปลาย 5 และ 3ลำดับกรดนิวคลีอิกที่ปลายทั้งสองจับคู่กัน ทำให้กลุ่มเรืองแสงและกลุ่มดับแน่นปิดจะไม่เกิดสารเรืองแสง
หลังจากสร้างผลิตภัณฑ์ PCR แล้ว ในระหว่างกระบวนการหลอม ส่วนตรงกลางของสัญญาณโมเลกุลจะถูกจับคู่กับลำดับดีเอ็นเอเฉพาะ และยีนเรืองแสงจะถูกแยกออกจากยีนดับเพื่อผลิตสารเรืองแสง
ข้อเสียเปรียบหลักของ PCR รุ่นที่สอง:
ความไวยังขาดอยู่และการตรวจจับชิ้นงานที่มีสำเนาต่ำนั้นไม่แม่นยำ
มีอิทธิพลต่อค่าพื้นหลัง และผลลัพธ์จะไวต่อสัญญาณรบกวน
PCR ดิจิทัลรุ่นที่สาม
Digital PCR (DigitalPCR, dPCR, Dig-PCR) คำนวณหมายเลขสำเนาของลำดับเป้าหมายผ่านการตรวจจับจุดสิ้นสุด และสามารถทำการตรวจจับเชิงปริมาณที่แม่นยำโดยไม่ต้องใช้การควบคุมภายในและเส้นโค้งมาตรฐาน
Digital PCR ใช้การตรวจจับจุดสิ้นสุดและไม่ขึ้นอยู่กับค่า Ct (เกณฑ์รอบ) ดังนั้นปฏิกิริยา PCR แบบดิจิทัลจึงได้รับผลกระทบน้อยลงจากประสิทธิภาพการขยายสัญญาณ และความทนทานต่อสารยับยั้งปฏิกิริยา PCR ได้รับการปรับปรุง โดยมีความแม่นยำสูงและความสามารถในการทำซ้ำ
เนื่องจากลักษณะเฉพาะของความไวสูงและความแม่นยำสูง จึงไม่ถูกแทรกแซงโดยสารยับยั้งปฏิกิริยา PCR อย่างง่ายดาย และสามารถบรรลุปริมาณสัมบูรณ์ที่แท้จริงโดยไม่ต้องใช้ผลิตภัณฑ์มาตรฐาน ซึ่งกลายเป็นฮอตสปอตการวิจัยและการประยุกต์ใช้
ตามรูปแบบต่างๆ ของหน่วยปฏิกิริยา สามารถแบ่งออกได้เป็นสามประเภท ได้แก่ ระบบไมโครฟลูอิดิก ระบบชิป และหยด
เวลาโพสต์: กรกฎาคม-08-2021