จัดทำ SOP การทดลอง PCR เพื่อสร้างมาตรฐานพฤติกรรมของบุคลากรในการทดลอง

ผู้ทดลองปฏิบัติตามขั้นตอนการปฏิบัติงานอย่างเคร่งครัด และลดมลพิษ PCR ที่อาจเกิดจากปัจจัยมนุษย์หรือป้องกันการเกิดมลพิษนอกจากนี้ ผู้ทดลองควรมีความรู้และทักษะทางวิชาชีพที่สอดคล้องกัน รวมถึงความชำนาญในการใช้งานอุปกรณ์ที่เกี่ยวข้อง ชี้แจงขั้นตอนการทำงานทั้งหมด เชี่ยวชาญวิธีการบำบัดสิ่งปนเปื้อนและวิธีการควบคุมคุณภาพห้องปฏิบัติการ และสามารถตีความผลการทดสอบได้อย่างถูกต้อง
จัดตั้งห้องปฏิบัติการ PCR ที่ได้มาตรฐาน

ห้องปฏิบัติการ PCR แบ่งออกเป็นสี่ส่วนตามหลักการ ได้แก่ พื้นที่เตรียมรีเอเจนต์ พื้นที่ประมวลผลตัวอย่าง พื้นที่ขยาย และพื้นที่วิเคราะห์ผลิตภัณฑ์ขยายพื้นที่สองส่วนแรกเป็นพื้นที่ก่อนการขยายสัญญาณ และสองพื้นที่สุดท้ายเป็นพื้นที่หลังการขยายสัญญาณควรแยกโซนก่อนขยายและโซนหลังขยายออกจากกันอย่างเคร่งครัดวัสดุทดลอง รีเอเจนต์ กระดาษบันทึก ปากกา วัสดุทำความสะอาด ฯลฯ สามารถไหลจากพื้นที่ก่อนขยายไปยังพื้นที่หลังขยาย นั่นคือ จากพื้นที่เตรียมรีเอเจนต์ → พื้นที่ประมวลผลตัวอย่าง → พื้นที่ขยาย → พื้นที่วิเคราะห์ผลิตภัณฑ์ขยาย และต้องไม่ไหลย้อนกลับการไหลของอากาศในห้องปฏิบัติการควรไหลจากพื้นที่ก่อนการขยายไปยังพื้นที่หลังการขยาย และไม่ไหลย้อนกลับการออกแบบห้องปฏิบัติการ PCR ในอุดมคติแสดงไว้ด้านล่าง:
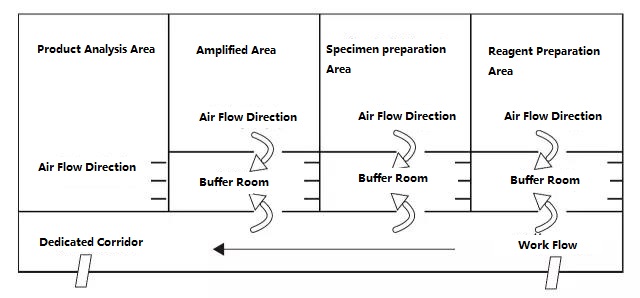
รูป A: โหมดการตั้งค่าห้องปฏิบัติการ PCR ในอุดมคติพร้อมแรงดันลบในห้องบัฟเฟอร์
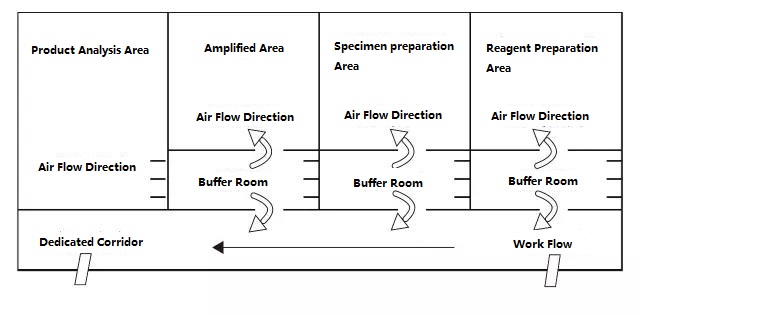
รูป B: โหมดการตั้งค่าห้องปฏิบัติการ PCR ในอุดมคติพร้อมแรงดันบวกในห้องบัฟเฟอร์
ไดอะแกรมการตั้งค่าห้องปฏิบัติการ PCR ที่ระบุในรูป A และรูป B ควรเป็นโหมดการตั้งค่าที่เหมาะสมกว่า และห้องปฏิบัติการที่มีเงื่อนไขสามารถอ้างถึงโหมดนี้สำหรับการออกแบบสำหรับห้องปฏิบัติการทั่วไป ขอแนะนำให้แยกพื้นที่ขยาย PCR และพื้นที่วิเคราะห์ผลิตภัณฑ์ และควรลดการเปิดฝาครอบลงในพื้นที่เตรียมตัวอย่างและพื้นที่ขยาย PCR ให้มากที่สุดข้อควรจำ: ห้ามนำผลิตภัณฑ์และอุปกรณ์การทดลองในพื้นที่วิเคราะห์ผลิตภัณฑ์ไปยังพื้นที่เตรียมตัวอย่างและพื้นที่ขยาย PCR โดยเด็ดขาด

หากห้องปฏิบัติการดำเนินการตรวจหาและระบุ PCR เท่านั้น ขอแนะนำให้ใช้ PCR เชิงปริมาณเรืองแสงแทน PCR ทั่วไป
ผลการตรวจจับ PCR เชิงปริมาณของฟลูออเรสเซนซ์สามารถรวบรวมและวิเคราะห์ได้ด้วยสัญญาณฟลูออเรสเซนซ์ ดังนั้นจึงไม่จำเป็นต้องเปิดฝาสำหรับอิเล็กโตรโฟรีซิสหลังจากเกิดปฏิกิริยา ซึ่งจะช่วยหลีกเลี่ยงการปนเปื้อนของผลิตภัณฑ์ PCR ที่เกิดจากการรั่วไหลของผลิตภัณฑ์ที่ทำปฏิกิริยาเพื่อสร้างละอองลอยหากคุณเพิ่มจำนวนของช่องเปิดในระหว่างขั้นตอนการโหลดเจลอิเล็กโตรโฟรีซิส อาจเกิดการปนเปื้อนของละอองลอยได้ขอแนะนำให้ส่งเสริมการประยุกต์ใช้ PCR เชิงปริมาณและค่อยๆ แทนที่ PCR เชิงคุณภาพ
ระบบป้องกันการปนเปื้อนของผลิตภัณฑ์ UNG anti-PCR ใช้สำหรับปฏิกิริยา PCR
ระบบใช้ dUTP แทน dTTPหลังจากปฏิกิริยา PCR ผลิตภัณฑ์ PCR ทั้งหมด (ชิ้นส่วน DNA) จะรวมเข้ากับ dUTPในรอบถัดไปของปฏิกิริยา PCR เอ็นไซม์ UNG ที่เติมเข้าไปในระบบจะถูกบ่มที่อุณหภูมิ 37°C เป็นเวลา 5 นาทีก่อน PCR ซึ่งสามารถย่อยสลายชิ้นส่วน DNA ทั้งหมดที่มี dUTP ได้อย่างเฉพาะเจาะจง จากนั้นจึงทำปฏิกิริยา PCRสิ่งนี้สามารถกำจัดการปนเปื้อนของละอองลอยที่เกิดจากผลิตภัณฑ์ PCR ได้อย่างสมบูรณ์ผลกระทบจะแสดงในรูปด้านล่าง:
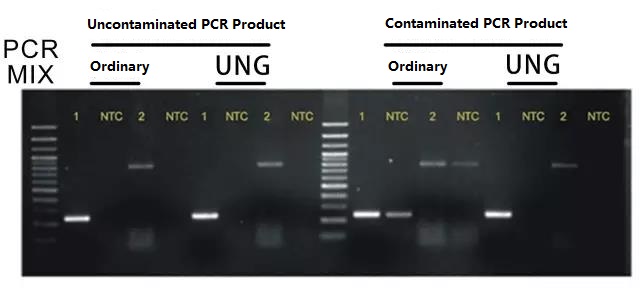
หมายเหตุ: สำหรับซีรีย์ PCR โดยตรง คุณสามารถเลือกซีรีย์ผลิตภัณฑ์ของระบบป้องกันการปนเปื้อนของผลิตภัณฑ์ PCR ของ Foregeneแนะนำ
สำหรับห้องปฏิบัติการที่ทำการทดสอบจีโนไทป์ขนาดใหญ่ ขอแนะนำให้ใช้ระบบการปนเปื้อนของผลิตภัณฑ์ UNG anti-PCR สำหรับการทดสอบรีเอเจนต์นอกเหนือจากการสร้างห้องปฏิบัติการที่เหมาะสม
คำเตือน: การใช้ระบบนี้ไม่สามารถกำจัดการปนเปื้อนของผลิตภัณฑ์ PCR ที่เกิดขึ้นแล้วได้ดังนั้นควรใช้ระบบ UNG ในช่วงเริ่มต้นของการทดสอบที่เกี่ยวข้อง และควรใช้ระบบ UNG สำหรับการขยาย PCR เพื่อป้องกันการปนเปื้อนของผลิตภัณฑ์ PCR ผลบวกลวง
ขอแนะนำให้ใช้ระบบ Direct PCR-UNG ของ Foregene เมื่อดำเนินการทดสอบขนาดใหญ่ เช่น:
Plant Leaf Direct PCR Kit-UNG;
ชุด PCR โดยตรงสำหรับเมล็ดพันธุ์พืช-UNG;
ชุด PCR โดยตรงจากเนื้อเยื่อสัตว์-UNG;
Mouse Tail Direct PCR Kit-UNG;
Zebra Fish Direct PCR Kit-UNG 。
ชุดคิทชุดนี้จาก Foregeneไม่เพียงแต่สามารถตรวจจับ PCR ได้อย่างรวดเร็วและในปริมาณมาก แต่ยังป้องกันและควบคุมการปนเปื้อนของผลิตภัณฑ์ PCR ได้อย่างมีประสิทธิภาพอีกด้วย
เวลาโพสต์: Mar-19-2021








