ในช่วงแรกของการระบาด เนื่องจากการพัฒนาอย่างรวดเร็ว การวินิจฉัยผู้ป่วยที่สงสัยอย่างรวดเร็วจึงเป็นกุญแจสำคัญในการป้องกัน COVID-19รีเอเจนต์สำหรับตรวจจับกรดนิวคลีอิกที่ผ่านการรับรองบางตัวมีเวลาในการพัฒนาสั้น และมีปัญหา เช่น การยืนยันประสิทธิภาพที่เร่งรีบ การปรับรีเอเจนต์ให้เหมาะสมไม่เพียงพอ และความแตกต่างอย่างมากระหว่างแบทช์ปัญหาของห้องปฏิบัติการทางคลินิกต่างๆ ในด้านต่างๆ ของกระบวนการตรวจหากรดนิวคลีอิกอาจส่งผลต่อความแม่นยำของผลการตรวจจับกรดนิวคลีอิกด้วยบทความนี้จะมุ่งเน้นไปที่การเชื่อมโยงและประเด็นสำคัญในการตรวจจับกรดนิวคลีอิกของ SARS-CoV-2 ในปัจจุบัน และวิเคราะห์ปัญหาของการตรวจหากรดนิวคลีอิกในห้องปฏิบัติการและความไม่สอดคล้องกันทางคลินิกที่เป็นเท็จและบวกซ้ำ
หลักการตรวจจับกรดนิวคลีอิก SARS-CoV-2
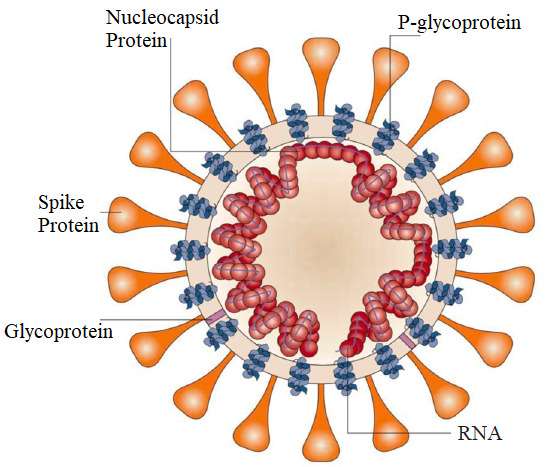
SARS-CoV-2 เป็นไวรัส RNA ที่มีลำดับจีโนมประมาณ 29 kb โดยมี 10 ยีน ซึ่งสามารถเข้ารหัสโปรตีน 10 ชนิดได้อย่างมีประสิทธิภาพไวรัสประกอบด้วย RNA และโปรตีน และชั้นนอกสุดเป็นสารเคลือบชั้นนอกที่ประกอบด้วยลิพิดและไกลโคโปรตีนภายใน โปรตีน capsid ห่อหุ้ม RNA ไว้ ดังนั้นจึงช่วยปกป้อง RNA (P1) ที่ย่อยสลายได้ง่าย
โครงสร้าง P1 ของ SARS-COV-2
ไวรัสบุกรุกเซลล์ผ่านตัวรับที่ผิวเซลล์เฉพาะเพื่อทำให้เกิดการติดเชื้อ และใช้เซลล์โฮสต์เพื่อทำซ้ำ
หลักการของการตรวจจับกรดนิวคลีอิกของไวรัสคือการเปิดเผย RNA ของไวรัสผ่านเซลล์ไลเสต จากนั้นใช้ปฏิกิริยาลูกโซ่โพลิเมอเรสย้อนกลับแบบฟลูออเรสเซนต์แบบเรียลไทม์ (RT-PCR) ในการตรวจจับ
กุญแจสำคัญของหลักการตรวจจับคือการใช้ไพรเมอร์และโพรบเพื่อให้ได้ "การจับคู่ที่ตรงเป้าหมาย" ของลำดับกรดนิวคลีอิก นั่นคือ การค้นหาลำดับกรดนิวคลีอิกของ SARS-CoV-2 ที่แตกต่างจากไวรัสอื่นๆ ในประมาณ 30,000 เบส (ความคล้ายคลึงกันของกรดนิวคลีอิกกับไวรัสอื่นๆ) พื้นที่ "ต่ำ") ออกแบบไพรเมอร์และโพรบ
ไพรเมอร์และหัววัดมีความเข้ากันได้สูงกับบริเวณเฉพาะของกรดนิวคลีอิก SARS-CoV-2 นั่นคือมีความจำเพาะสูงเมื่อผลการขยายหลอดฟลูออเรสเซนต์ RT-PCR แบบเรียลไทม์ของตัวอย่างที่จะทดสอบเป็นบวก ก็จะพิสูจน์ได้ว่ามี SARS-CoV-2 อยู่ในตัวอย่างดูหน้า 2
ขั้นตอน P2 ของการวัดกรดนิวคลีอิก SARS-CoV-2 (RT-PCR เรืองแสงตามเวลาจริง)
เงื่อนไขและข้อกำหนดของห้องปฏิบัติการสำหรับการตรวจหากรดนิวคลีอิกของ SARS-CoV-2
ห้องปฏิบัติการทดสอบกรดนิวคลีอิกเหมาะที่สุดสำหรับสภาพแวดล้อมที่มีแรงดันเป็นลบ และควรให้ความสนใจกับการตรวจสอบแรงดัน ให้อากาศไหลเวียน และกำจัดละอองลอยบุคลากรที่ทำการทดสอบกรดนิวคลีอิกต้องมีคุณสมบัติที่สอดคล้องกัน ได้รับการฝึกอบรมเกี่ยวกับปฏิกิริยาลูกโซ่โพลิเมอเรสที่เกี่ยวข้อง และผ่านการประเมินห้องปฏิบัติการควรได้รับการจัดการอย่างเข้มงวด จัดโซน และห้ามไม่ให้บุคลากรที่ไม่เกี่ยวข้องเข้าไปโดยเด็ดขาดบริเวณที่สะอาดควรมีการระบายอากาศและฆ่าเชื้อในสถานที่สิ่งของที่เกี่ยวข้องจะถูกจัดแยกเป็นโซน แยกส่วนที่สะอาดและสกปรก เปลี่ยนใหม่ตรงเวลา และกำจัดสิ่งปนเปื้อนในสถานที่การฆ่าเชื้อตามปกติ: น้ำยาฆ่าเชื้อที่มีคลอรีนเป็นวิธีแก้ปัญหาหลักสำหรับพื้นที่ขนาดใหญ่ และสามารถใช้แอลกอฮอล์ 75% สำหรับพื้นที่ขนาดเล็กได้วิธีที่ดีในการจัดการกับละอองลอยคือการเปิดหน้าต่างเพื่อระบายอากาศ และการฆ่าเชื้อโรคในอากาศสามารถทำได้โดยใช้รังสีอัลตราไวโอเลต การกรอง และการฆ่าเชื้อโรคในอากาศ
ลิงก์หลักและพารามิเตอร์ของการวัดกรดนิวคลีอิก SARS-CoV-2 (RT-PCR เรืองแสงตามเวลาจริง)
แม้ว่าโดยทั่วไปแล้วห้องปฏิบัติการจะให้ความสำคัญกับ "การตรวจหา" กรดนิวคลีอิกอย่างใกล้ชิด แต่ในความเป็นจริงแล้ว "การสกัด" กรดนิวคลีอิกก็เป็นหนึ่งในขั้นตอนสำคัญสำหรับการตรวจหาที่ประสบความสำเร็จ ซึ่งเกี่ยวข้องอย่างใกล้ชิดกับการรวบรวมและจัดเก็บตัวอย่างไวรัส
ในปัจจุบัน ตัวอย่างระบบทางเดินหายใจที่ใช้กันอย่างแพร่หลาย เช่น nasopharyngeal swabs ใช้วิธีที่สอง ซึ่งเป็นสารละลายยับยั้ง (การเก็บรักษา) ที่เตรียมขึ้นจากการสกัดกรดนิวคลีอิกและสารละลายสลายในแง่หนึ่ง วิธีการรักษาไวรัสนี้สามารถทำลายโปรตีนของไวรัส สูญเสียการทำงานของมันและไม่แพร่เชื้ออีกต่อไป และปรับปรุงความปลอดภัยของขั้นตอนการขนส่งและการตรวจจับในทางกลับกัน มันสามารถแตกไวรัสได้โดยตรงเพื่อปล่อยกรดนิวคลีอิก กำจัดเอนไซม์ที่ย่อยสลายกรดนิวคลีอิก และป้องกันไวรัสRNA ถูกย่อยสลาย
สารละลายสุ่มตัวอย่างไวรัสที่เตรียมขึ้นบนพื้นฐานของสารละลายสลายกรดนิวคลีอิกส่วนประกอบหลัก ได้แก่ เกลือที่สมดุล สารคีเลตกรดเอธิลีนไดอามีนเตตระอะซิติก เกลือกัวนิดีน (กัวนิดีนไอโซไทโอไซยาเนต กัวนิดีนไฮโดรคลอไรด์ ฯลฯ) สารลดแรงตึงผิวประจุลบ (โดดีเคน) โซเดียมซัลเฟต) สารลดแรงตึงผิวประจุบวก (เตตระเดซิลไตรเมทิลแอมโมเนียมออกซาเลต) ฟีนอล 8-ไฮดรอกซีควิโนลีน ไดไทโอทรีทอล โปรตีเนส K และส่วนประกอบอื่นๆ อีกหลายอย่างหรือมากกว่าในปัจจุบัน มีชุดอุปกรณ์สกัดกรดนิวคลีอิกหลายประเภท และมีการใช้รีเอเจนต์การสกัดกรดนิวคลีอิกและการทำให้บริสุทธิ์ที่แตกต่างกันแม้ว่าจะใช้การสกัดกรดนิวคลีอิกและการทำให้บริสุทธิ์รีเอเจนต์เดียวกัน ขั้นตอนการสกัดของแต่ละชุดจะแตกต่างกัน
ในปัจจุบัน ผลิตภัณฑ์ชุดตรวจหากรดนิวคลีอิกที่ได้รับอนุมัติจาก National Medical Products Administration ได้รับเลือกตามยีน ORF1ab, E และ N ในจีโนม SARS-CoV-2หลักการตรวจจับของผลิตภัณฑ์ต่างๆ นั้นโดยพื้นฐานแล้วเหมือนกัน แต่การออกแบบไพรเมอร์และโพรบนั้นแตกต่างกันมีกลุ่มเป้าหมายเดียว (ORF1ab) กลุ่มเป้าหมายคู่ (ORF1ab, N หรือ E) และกลุ่มเป้าหมายสามกลุ่ม (ORF1ab, N และ E)ความแตกต่างระหว่างการตรวจจับและการแปลผล การสกัดกรดนิวคลีอิก และระบบปฏิกิริยา RT-PCR เรืองแสงตามเวลาจริงควรอ้างอิงถึงคำแนะนำชุดอุปกรณ์ที่เกี่ยวข้อง และขอแนะนำให้ผู้ใช้ปฏิบัติตามวิธีการตีความที่ระบุไว้ในคำแนะนำชุดอุปกรณ์อย่างเคร่งครัดเพื่อตีความพื้นที่ทั่วไป ไพรเมอร์ และลำดับโพรบที่ขยายโดย RT-PCR ฟลูออเรสเซนต์แบบเรียลไทม์แสดงใน P3
P3 ตำแหน่งของแอมพลิคอนเป้าหมาย SARS-CoV-2 บนจีโนมและลำดับของไพรเมอร์และโพรบ
การแปลผลการตรวจหากรดนิวคลีอิกของ SARS-CoV-2 (Rเอล-Time ฟลูออเรสเซนต์ RT-PCR)
“แผนการป้องกันและควบคุมโรคปอดอักเสบจากการติดเชื้อ SARS-CoV-2 (ฉบับที่ 2)” เป็นครั้งแรก ซึ่งได้ชี้แจงเกณฑ์การตัดสินผลการเพิ่มจำนวนยีนเดี่ยว:
1. ไม่มี Ct หรือ Ct≥40 เป็นค่าลบ
2. Ct <37 เป็นบวก;
3. ค่า Ct ของ 37-40 คือพื้นที่ระดับสีเทาขอแนะนำให้ทำการทดลองซ้ำหากผลลัพธ์ของการทำซ้ำ Ct <40 และกราฟการขยายมีพีคที่ชัดเจน ตัวอย่างจะถูกตัดสินว่าเป็นบวก มิฉะนั้นจะเป็นลบ”
คู่มือฉบับที่สามและฉบับที่สี่ยังคงใช้เกณฑ์ข้างต้นอย่างไรก็ตาม เนื่องจากเป้าหมายที่แตกต่างกันที่ใช้ในชุดเชิงพาณิชย์ คู่มือฉบับที่ 3 ข้างต้นไม่ได้ให้เกณฑ์สำหรับการพิจารณาเป้าหมายร่วมกัน โดยเน้นย้ำว่าคำแนะนำที่ผู้ผลิตให้มาจะมีผลเหนือกว่าเริ่มจากแนวปฏิบัติฉบับที่ 5 ได้มีการชี้แจงเป้าหมาย 2 เป้าหมาย โดยเฉพาะอย่างยิ่งเกณฑ์การตัดสินสำหรับเป้าหมายเดียวที่ตัดสินได้ยากนั่นคือ หากห้องปฏิบัติการต้องการยืนยันว่าผู้ป่วยตรวจพบกรดนิวคลีอิก SARS-CoV-2 ในเชิงบวก เงื่อนไขต่อไปนี้จะต้องเป็นไปตาม 1 ใน 2 เงื่อนไข:
(1) เป้าหมาย 2 เป้าหมายของ SARS-CoV-2 (ORF1ab, N) ในตัวอย่างเดียวกันได้รับการทดสอบในเชิงบวกโดย RT-PCR เรืองแสงแบบเรียลไทม์หากเป้าหมายเดียวเป็นบวก จำเป็นต้องมีการสุ่มตัวอย่างซ้ำและทดสอบซ้ำหากผลการทดสอบเป็น หากเป้าหมายเดียวยังคงเป็นบวก ก็จะตัดสินว่าเป็นบวก
(2) RT-PCR หลอดฟลูออเรสเซนต์แบบเรียลไทม์สองตัวอย่างแสดงผลบวกเป้าหมายเดียวในเวลาเดียวกัน หรือสองตัวอย่างประเภทเดียวกันแสดงผลการทดสอบเชิงบวกเป้าหมายเดียว ซึ่งสามารถตัดสินได้ว่าเป็นบวกอย่างไรก็ตาม แนวปฏิบัติยังเน้นย้ำว่าผลการทดสอบกรดนิวคลีอิกเป็นลบไม่สามารถแยกการติดเชื้อ SARS-CoV-2 ได้ปัจจัยต่างๆ ที่อาจก่อให้เกิดผลลบปลอมจำเป็นต้องได้รับการยกเว้น รวมถึงตัวอย่างที่มีคุณภาพต่ำ (ตัวอย่างจากระบบทางเดินหายใจจากช่องคอและส่วนอื่นๆ) การเก็บตัวอย่างเร็วเกินไปหรือช้าเกินไป ตัวอย่างไม่ได้รับการจัดเก็บ ขนส่ง และดำเนินการอย่างถูกต้อง และเทคโนโลยีเองมีปัญหา (รูปแบบไวรัส การยับยั้ง PCR) เป็นต้น
สาเหตุของผลลบลวงในการตรวจจับ SARS-CoV-2
แนวคิดของ "ผลลบที่ผิดพลาด" ในการทดสอบกรดนิวคลีอิกที่กำลังเป็นกังวล มักหมายถึง "ผลเชิงลบที่ผิดพลาด" ซึ่งผลการทดสอบกรดนิวคลีอิกไม่สอดคล้องกับอาการแสดงทางคลินิก กล่าวคือ อาการทางคลินิกและผลการถ่ายภาพเป็นที่สงสัยว่าเป็น COVID-19 อย่างมาก แต่การทดสอบกรดนิวคลีอิกมักให้ผลเป็น "ลบ" หลายครั้งศูนย์ห้องปฏิบัติการทางคลินิกของคณะกรรมการสุขภาพแห่งชาติอธิบายการทดสอบ SARS-CoV-2 “ผลลบลวง”
(1) มีไวรัสจำนวนหนึ่งในเซลล์ของผู้ติดเชื้อข้อมูลที่มีอยู่แสดงให้เห็นว่าหลังจากที่ร่างกายติดเชื้อไวรัส ไวรัสจะเข้าสู่ลำคอทางจมูกและปาก จากนั้นไปที่หลอดลมและหลอดลม จากนั้นจึงไปถึงถุงลมผู้ติดเชื้อจะมีอาการระยะฟักตัว อาการเล็กน้อย ระยะอาการรุนแรง และระยะต่างๆ ของโรคและปริมาณของไวรัสที่อยู่ในส่วนต่าง ๆ ของร่างกายก็แตกต่างกัน
ในแง่ของปริมาณไวรัสของประเภทเซลล์ เซลล์เยื่อบุผิวถุง (ทางเดินหายใจส่วนล่าง) > เซลล์เยื่อบุผิวทางเดินหายใจ (ทางเดินหายใจส่วนบน) > ไฟโบรบลาสต์ เซลล์บุผนังหลอดเลือด และแมคโครฟาจ ฯลฯจากประเภทตัวอย่าง alveolar lavage fluid (ดีที่สุด)>เสมหะไอลึก>nasopharyngeal swab>oropharyngeal swab>เลือดนอกจากนี้ยังสามารถตรวจพบเชื้อไวรัสในอุจจาระได้อีกด้วยอย่างไรก็ตาม เมื่อคำนึงถึงความสะดวกของการผ่าตัดและการยอมรับของผู้ป่วย คำสั่งตัวอย่างทางคลินิกที่ใช้กันทั่วไปคือ
ดังนั้นปริมาณไวรัสในเซลล์ของ oropharynx หรือ nasopharynx ของผู้ป่วยบางรายจึงมีน้อยหรือน้อยมากหากนำเฉพาะตัวอย่างของคอหอยหรือโพรงหลังจมูกไปตรวจ จะตรวจไม่พบกรดนิวคลีอิกของไวรัส
(2) ไม่มีการเก็บเซลล์ที่มีไวรัสในระหว่างการเก็บตัวอย่าง หรือกรดนิวคลีอิกของไวรัสไม่ได้รับการเก็บรักษาไว้อย่างมีประสิทธิภาพ
[① สถานที่เก็บตัวอย่างไม่เหมาะสม เช่น เมื่อเก็บก้อนเชื้อจากโพรงจมูก ความลึกของก้อนเชื้อไม่เพียงพอ ก้อนเชื้อจากโพรงหลังจมูกที่เก็บได้ไม่ลึกเข้าไปในโพรงจมูก เป็นต้น เซลล์ส่วนใหญ่ที่เก็บได้อาจเป็นเซลล์ที่ไม่มีไวรัส
②Sampling swab ใช้อย่างไม่ถูกต้องตัวอย่างเช่น แนะนำให้ใช้เส้นใยสังเคราะห์ เช่น เส้นใย PE เส้นใยโพลีเอสเตอร์ และเส้นใยโพลีโพรพิลีนสำหรับวัสดุของหัวไม้กวาดเส้นใยธรรมชาติ เช่น ฝ้าย ถูกนำมาใช้ในการทำงานจริง (ดูดซับโปรตีนได้ดีและไม่ล้างออกง่าย) และเส้นใยไนลอน (ดูดซับน้ำได้ไม่ดี ทำให้ปริมาณตัวอย่างไม่เพียงพอ)
③การใช้หลอดเก็บไวรัสอย่างไม่ถูกต้อง เช่น การใช้หลอดพลาสติกโพลีโพรพีลีนหรือโพลีเอทิลีนที่ดูดซับกรดนิวคลีอิก (DNA/RNA) ได้ง่ายในทางที่ผิด ส่งผลให้ความเข้มข้นของกรดนิวคลีอิกในสารละลายกักเก็บลดลงในทางปฏิบัติ ขอแนะนำให้ใช้พลาสติกโพลิเมอร์โพลีเอทิลีน-โพรพิลีนและภาชนะพลาสติกโพลีโพรพีลีนที่ผ่านการบำบัดเป็นพิเศษเพื่อเก็บกรดนิวคลีอิกของไวรัส]
[① สถานที่เก็บตัวอย่างไม่เหมาะสม เช่น เมื่อเก็บก้อนเชื้อจากโพรงจมูก ความลึกของก้อนเชื้อไม่เพียงพอ ก้อนเชื้อจากโพรงหลังจมูกที่เก็บได้ไม่ลึกเข้าไปในโพรงจมูก เป็นต้น เซลล์ส่วนใหญ่ที่เก็บได้อาจเป็นเซลล์ที่ไม่มีไวรัส
②Sampling swab ใช้อย่างไม่ถูกต้องตัวอย่างเช่น แนะนำให้ใช้เส้นใยสังเคราะห์ เช่น เส้นใย PE เส้นใยโพลีเอสเตอร์ และเส้นใยโพลีโพรพิลีนสำหรับวัสดุของหัวไม้กวาดเส้นใยธรรมชาติ เช่น ฝ้าย ถูกนำมาใช้ในการทำงานจริง (ดูดซับโปรตีนได้ดีและไม่ล้างออกง่าย) และเส้นใยไนลอน (ดูดซับน้ำได้ไม่ดี ทำให้ปริมาณตัวอย่างไม่เพียงพอ)
③การใช้หลอดเก็บไวรัสอย่างไม่ถูกต้อง เช่น การใช้หลอดพลาสติกโพลีโพรพีลีนหรือโพลีเอทิลีนที่ดูดซับกรดนิวคลีอิก (DNA/RNA) ได้ง่ายในทางที่ผิด ส่งผลให้ความเข้มข้นของกรดนิวคลีอิกในสารละลายกักเก็บลดลงในทางปฏิบัติ ขอแนะนำให้ใช้พลาสติกโพลิเมอร์โพลีเอทิลีน-โพรพิลีนและภาชนะพลาสติกโพลีโพรพีลีนที่ผ่านการบำบัดเป็นพิเศษเพื่อเก็บกรดนิวคลีอิกของไวรัส]
(4) การดำเนินการทางห้องปฏิบัติการทางคลินิกไม่ได้มาตรฐานเงื่อนไขการขนส่งและการเก็บรักษาตัวอย่าง การทำงานที่ได้มาตรฐานของห้องปฏิบัติการทางคลินิก การแปลผลและการควบคุมคุณภาพเป็นปัจจัยสำคัญที่ทำให้มั่นใจถึงความถูกต้องและความน่าเชื่อถือของผลการทดสอบจากผลการประเมินคุณภาพภายนอกที่จัดทำโดยศูนย์ห้องปฏิบัติการทางคลินิกของสำนักงานคณะกรรมการสุขภาพแห่งชาติ เมื่อวันที่ 16-24 มีนาคม 2563 จำนวน 844 ห้องปฏิบัติการที่ได้ผลถูกต้อง 701 แห่ง (ร้อยละ 83.1) ไม่ผ่านเกณฑ์ 143 แห่ง (ร้อยละ 16.9)ผ่านการรับรอง สภาวะการทดสอบในห้องปฏิบัติการโดยรวมอยู่ในเกณฑ์ดี แต่ห้องปฏิบัติการต่างๆ ยังคงมีความแตกต่างในด้านความสามารถในการปฏิบัติงานของบุคลากร ความสามารถในการตีความตัวอย่างที่เป็นบวกเป้าหมายเดียว และการควบคุมคุณภาพ
จะลดการตรวจพบกรดนิวคลีอิก SARS-CoV-2 ได้อย่างไร
การลดผลลบปลอมในการตรวจจับกรดนิวคลีอิกควรได้รับการปรับให้เหมาะสมจากสี่ด้านของการสร้างผลลบลวง
(1) มีไวรัสจำนวนหนึ่งในเซลล์ของผู้ติดเชื้อความเข้มข้นของไวรัสในส่วนต่าง ๆ ของร่างกายของผู้ที่สงสัยว่าติดเชื้อจะแตกต่างกันในแต่ละช่วงเวลาหากไม่มีคอหอย อาจอยู่ในน้ำล้างหลอดลมหรืออุจจาระหากสามารถเก็บตัวอย่างได้หลายประเภทในเวลาเดียวกันหรือในระยะต่างๆ ของการดำเนินโรคเพื่อการทดสอบ จะช่วยหลีกเลี่ยงผลลบที่ผิดพลาดได้
(2) ควรเก็บเซลล์ที่มีไวรัสในระหว่างการเก็บตัวอย่างปัญหานี้สามารถแก้ไขได้ในระดับใหญ่โดยการฝึกอบรมผู้เก็บตัวอย่างให้เข้มแข็ง
(3) น้ำยา IVD ที่เชื่อถือได้ด้วยการดำเนินการวิจัยเกี่ยวกับการประเมินประสิทธิภาพการตรวจจับของรีเอเจนต์ในระดับประเทศ และการหารือเกี่ยวกับปัญหาที่มีอยู่ ประสิทธิภาพการตรวจจับของรีเอเจนต์สามารถปรับปรุงเพิ่มเติมและปรับปรุงความไวของการวิเคราะห์ได้
(4) การปฏิบัติงานที่เป็นมาตรฐานของห้องปฏิบัติการทางคลินิกการเสริมสร้างการฝึกอบรมบุคลากรในห้องปฏิบัติการ การปรับปรุงระบบการจัดการคุณภาพห้องปฏิบัติการอย่างต่อเนื่อง การรับรองการแบ่งส่วนที่เหมาะสม และการปรับปรุงความสามารถของบุคลากรในการตรวจจับ จึงเป็นไปได้ที่จะลดผลลบที่ผิดพลาดเนื่องจากการปฏิบัติการในห้องปฏิบัติการที่ไม่เหมาะสม
เหตุผลในการทดสอบกรดนิวคลีอิก SARS-CoV-2 ซ้ำในเชิงบวกในผู้ป่วยที่หายและออกจากโรงพยาบาล
“แผนการวินิจฉัยและการรักษา COVID-19 (ฉบับทดลองฉบับที่ 7)” กำหนดอย่างชัดเจนว่าหนึ่งในเกณฑ์สำหรับผู้ป่วย COVID-19 ที่จะได้รับการรักษาและออกจากโรงพยาบาลคือตัวอย่างระบบทางเดินหายใจสองตัวอย่างติดต่อกันมีผลการทดสอบกรดนิวคลีอิกเป็นลบ (ห่างกันอย่างน้อย 24 ชั่วโมง) แต่มีน้อยมากที่การทดสอบกรดนิวคลีอิกของ SARS-CoV-2 ให้ผลบวกอีกครั้งในผู้ป่วยที่ออกจากโรงพยาบาลเนื่องจากสาเหตุหลายประการ
(1)SARS-CoV-2 เป็นไวรัสตัวใหม่จำเป็นต้องเข้าใจกลไกการก่อโรคเพิ่มเติม ภาพทั้งหมดของโรคที่เกิด และลักษณะของโรคดังนั้นในแง่หนึ่งจำเป็นต้องเสริมสร้างการจัดการผู้ป่วยที่ออกจากโรงพยาบาลและดำเนินการสังเกตทางการแพทย์ 14 วันดำเนินการติดตาม ตรวจสุขภาพ และให้คำแนะนำด้านสุขภาพเพื่อให้เข้าใจกระบวนการทั้งหมดของการเกิด การพัฒนา และผลลัพธ์ของโรคอย่างลึกซึ้งยิ่งขึ้น
(2)ผู้ป่วยอาจติดเชื้อไวรัสอีกครั้งนักวิชาการ Zhong Nanshan กล่าวว่า: เนื่องจากผู้ป่วยที่หายแล้วมีแอนติบอดี SARS-CoV-2 จึงสามารถกำจัดได้ด้วยแอนติบอดีเมื่อพวกมันบุกรุกอีกครั้งมีหลายสาเหตุ ซึ่งอาจเป็นสาเหตุของผู้ป่วยที่หายดีแล้ว หรืออาจเกี่ยวข้องกับการกลายพันธุ์ของไวรัส หรือแม้แต่สาเหตุจากการตรวจทางห้องปฏิบัติการหากเป็นไวรัสเอง การกลายพันธุ์ของ SARS-CoV-2 อาจทำให้แอนติบอดีที่ผลิตโดยผู้ป่วยที่หายเป็นปกติไม่สามารถต่อต้านไวรัสที่กลายพันธุ์ได้หากผู้ป่วยติดเชื้อไวรัสกลายพันธุ์อีกครั้ง การทดสอบกรดนิวคลีอิกอาจเป็นบวกอีกครั้ง
(3) เท่าที่เกี่ยวกับวิธีการทดสอบในห้องปฏิบัติการ วิธีการทดสอบแต่ละวิธีมีข้อจำกัดการตรวจจับกรดนิวคลีอิกของ SARS-CoV-2 เกิดจากการเลือกลำดับยีน องค์ประกอบของรีเอเจนต์ ความไวของวิธีการ และเหตุผลอื่นๆ ทำให้ชุดตรวจที่มีอยู่มีขีดจำกัดการตรวจจับที่ต่ำกว่าของตัวเองหลังจากผู้ป่วยได้รับการรักษาไวรัสในร่างกายจะลดลงเมื่อปริมาณไวรัสในตัวอย่างที่จะทดสอบต่ำกว่าขีดจำกัดล่างของการตรวจจับ ผลลัพธ์ "ลบ" จะปรากฏขึ้นอย่างไรก็ตาม ผลลัพธ์นี้ไม่ได้หมายความว่าไวรัสในร่างกายหายไปอย่างสมบูรณ์ไวรัสอาจเป็นหลังจากหยุดการรักษาการฟื้นคืนชีพ” ให้คัดลอกต่อไปดังนั้นจึงแนะนำให้ทบทวนสัปดาห์ละครั้งภายใน 2 ถึง 4 สัปดาห์หลังออกจากโรงพยาบาล
(4) กรดนิวคลีอิกเป็นสารพันธุกรรมของไวรัสไวรัสถูกฆ่าตายหลังจากผู้ป่วยได้รับการรักษาด้วยยาต้านไวรัส แต่ชิ้นส่วน RNA ของไวรัสที่เหลืออยู่ยังคงอยู่ในร่างกายมนุษย์ และไม่ถูกขับออกจากร่างกายจนหมดบางครั้งภายใต้สถานการณ์บางอย่าง มันสามารถเก็บไว้ได้มากขึ้นเป็นเวลานาน และในเวลานี้การทดสอบกรดนิวคลีอิกจะเป็นผลบวก "ชั่วคราว"ด้วยการขยายเวลาพักฟื้นของผู้ป่วย หลังจากที่ชิ้นส่วน RNA ที่ตกค้างในร่างกายค่อยๆ หมดลง ผลการทดสอบกรดนิวคลีอิกอาจกลายเป็นลบได้
(5) ผลการทดสอบกรดนิวคลีอิกของ SARS-CoV-2 พิสูจน์ได้ว่ามีหรือไม่มี RNA ของไวรัสเท่านั้น และไม่สามารถพิสูจน์กิจกรรมของไวรัสและการแพร่เชื้อของไวรัสได้หรือไม่จำเป็นต้องพิสูจน์ว่าผู้ป่วยที่มีผลการทดสอบกรดนิวคลีอิกเป็นบวกอีกครั้งจะกลายเป็นแหล่งที่มาของการติดเชื้ออีกครั้งหรือไม่จำเป็นต้องดำเนินการเพาะเลี้ยงไวรัสในตัวอย่างทางคลินิกและเพาะเลี้ยงไวรัส "มีชีวิต" เพื่อพิสูจน์ว่าติดเชื้อ
สรุป
โดยสรุป กรดนิวคลีอิก SARS-CoV-2 ทดสอบผลลบลวง ทดสอบซ้ำผลบวก และสภาวะอื่นๆ ที่ไม่สอดคล้องกับอาการแสดงทางคลินิกไม่สามารถหลีกเลี่ยงได้โดยสิ้นเชิงในการคัดกรองและการทดสอบจริง ขอแนะนำให้รวมอาการทางคลินิก การตรวจด้วยภาพ (CT) และผลการทดลอง การทดสอบในห้องปฏิบัติการ (การทดสอบกรดนิวคลีอิก + การทดสอบแอนติบอดีจำเพาะต่อไวรัส) เพื่อการวินิจฉัยที่ครอบคลุม เพื่อป้องกันการวินิจฉัยพลาดและการวินิจฉัยผิดพลาดหากพบว่าผลการทดสอบไม่สอดคล้องกับอาการทางคลินิกอย่างเห็นได้ชัด ขอแนะนำให้ทำการวิเคราะห์อย่างครอบคลุมของลิงก์การทดสอบทั้งหมด (ลิงก์การเก็บตัวอย่าง การไหลเวียน และการประมวลผล) เพื่อไม่รวมการติดเชื้อไวรัส SARS-CoV-2 ในระยะแรก การติดเชื้อซ้ำ หรือร่วมกับการติดเชื้อไวรัสทางเดินหายใจอื่นๆ ฯลฯ ที่เป็นไปได้หากเงื่อนไขอนุญาต ขอแนะนำให้เก็บตัวอย่างที่ละเอียดอ่อน เช่น เสมหะหรือของเหลวล้างถุงเพื่อตรวจซ้ำ
สินค้าที่เกี่ยวข้อง:
ชุดตรวจจับกรดนิวคลีอิก SARS-CoV-2 (วิธีมัลติเพล็กซ์ PCR Fluorescent Probe)
เวลาโพสต์: Sep-03-2021